Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором
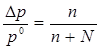 |
равно молярной (мольной) доле растворенного вещества.
где ро – давление насыщенного пара растворителя при данной температуре,
р –давление пара растворителя над раствором,
Dр = р0 – р понижение давления насыщенного пара растворителя ,
n - число молей растворенного вещества,
N - число молей растворителя.
Понижение давления пара над раствором находит свое отражение на диаграмме состояния. Рассмотрим диаграмму состояния воды и раствора нелетучего компонента (рис.16). Согласно закону Рауля при любой температуре давление водяного пара над водным раствором ниже, чем над водой. Поэтому кривая фазового перехода от жидкого состояния к пару для раствора расположена ниже, чем для чистой воды. Аналогично изменяется положение кривой плавления. Обе кривые для раствора будут располагаться тем дальше от соответствующих кривых воды, чем больше концентрация раствора.
Температуры фазовых переходов (кипения или плавления (замерзания)).
Индивидуальные вещества характеризуются строго определенными температурами перехода одного агрегатного состояния в другое (температура кипения или плавления (замерзания)). Для воды при нормальном давлении 101,3 кПа - это 100°С и 0°С.
Иначе обстоит дело с растворами. В большинстве случаев кристаллизуется (при замерзании) и выкипает (при кипении) только растворитель. Любая жидкость закипает, когда давление насыщенного пара ее становится равным атмосферному давлению. Замерзает раствор тогда, когда давление насыщенного пара его становится равным давлению насыщенного пара твердого растворителя. Присутствие растворенного вещества понижает температуру замерзания и повышает температуру кипения (как это видно из диаграммы состояния).
Дата добавления: 2014-12-09; просмотров: 1327;
