Кинетика коррозионного процесса
Термодинамика определяет возможность протекания коррозионного процесса, кинетика определяет его скорость. Скорость коррозии определяется величиной коррозионного тока, то есть количеством электричества, протекающего через поверхность металлического изделия в единицу времени. Сила коррозионного тока определяется из закона Ома:
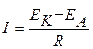 ,
,
где R - общее сопротивление протекания коррозионного процесса, которое включает в себя поляризационное сопротивление катодного и анодного процессов; сопротивление коррозионной среды или пленок продуктов коррозии, образующихся на поверхности металла.
Пленки продуктов коррозии (Fe2O3·nH2O, Al2O3, Zn(OH)2 и т.д.) обладают высоким электрическим сопротивлением, вызывают поляризацию катодного и анодного процессов и, следовательно, могут тормозить процесс коррозии. В качестве примера можно назвать такие металлы, как хром и алюминий, которые относятся к активным металлам (EoCr/Cr3+ = – 0,74B; EoAl/Al3+ = – 1,66B). В коррозионных средах, содержащих кислород, на их поверхности образуется тонкая сплошная оксидная пленка, обладающая высоким сопротивлением и поэтому значительно тормозящая процесс коррозии.
Таким образом, кинетический фактор часто определяет реальную скорость коррозионного процесса, т.е. процесс может быть термодинамически возможным, и он начинает протекать, однако продукты коррозии, в некоторых случаях образующие сплошные защитные пленки, значительно тормозят процесс коррозии, и металл пассивируется. Самопассивирующимися металлами являются Be, Al, Ti, Cr, Ni и некоторые другие. Анодный процесс окисления этих металлов сопровождается образованием оксида:
2Сr0 - 6e + 3H2O → Cr2O3 + 6H+
Дата добавления: 2014-12-05; просмотров: 1270;
