Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
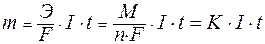 ,
,
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
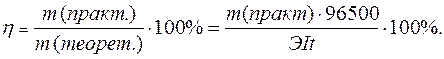
Дата добавления: 2014-12-05; просмотров: 3579;
