Методические указания. В термодинамике переход рабочего тела из одного равновесного состояния в другое совершается в обратимом термодинамическом процессе
В термодинамике переход рабочего тела из одного равновесного состояния в другое совершается в обратимом термодинамическом процессе. Задание начального и конечного состояний рабочего тела означает полное знание всех термодинамических параметров состояния начальной и конечной точек процесса. Основная задача исследования термодинамического процесса — определение теплоты (q1-2). участвующей в процессе, и работы изменения объема рабочего тела (ll-2). Такие величины, как изменение внутренней энергии ( 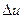 l-2), энтальпии (∆h1-2) и энтропии (∆S1-2) являются вспомогательными, служащими для решения основной задачи.
l-2), энтальпии (∆h1-2) и энтропии (∆S1-2) являются вспомогательными, служащими для решения основной задачи.
Общий метод исследования термодинамических процессов называется универсальным, не зависящим от природы рабочего тела. Метод базируется на применении уравнения первого закона термодинамики, записанного в двух равнозначных формах:ql-2 = ∆ul-2 + 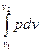 = ∆hl-2 –
= ∆hl-2 – 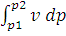 .
.
Различие в применение общего метода исследования к идеальным газам и водяному пару обусловлено отсутствием для пара такого просто го уравнения состояния, как уравнение Клапейрона для идеального газа, и сложной зависимостью теплоёмкости пара от температуры и давления. Поэтому решение основной задачи для идеального газа опирается на конечные аналитические зависимости, в то время как для пара применение общего метода требует использования таблиц или диаграммы Ts.
Водяной пар является рабочим телом в современных теплосиловых установках, а также находит широкое применение в различных технологических процессах. Необходимо разобраться в процессе парообpaзования и уметь изображать этот процесс в pv- и Ts диаграммах. Параметры водяного пара можно определить ли таблицам. Для успешного решения различных задач, связанных с водяным паром, научитесь схематично изображать основные процессы (изобарный, изохорный, изотермический и адиабатный) и диаграммы pv, Ts и hs.
Уясните понятие политропного процесса, под которым понимается любой термодинамический процесс идеального газа с постоянной теплоемкостью (или показателем политропы n) в этом процессе, общность политропного процесса, выраженного уравнением pvn = const, получая из него уравнение известных основных процессов (изохорного, изобарного, изотермического и адиабатного). Разберитесь в определении показателя политропы и теплоемкости политропного процесса идеального газа, как обобщающих величин, из которых получают частные значения для основных процессов.
Научитесь изображать графически в pv- и Ts-диаграммах как основные, так и общие политропные процессы.
Литература: [1] с. 63—75, 89—95, [2] с. 33—35, 80—92, 162-178.
Вопросы для самопроверки
1. Какие термодинамические процессы рабочего тела называют основными? 2. Изобразите в pv- и Ts-диаграммах основные процессы идеального газа и приведите характеристику каждому из них. 3. Чему равен показатель политропы в основных процессах идеального газа? 4. Чему равна теплоемкость политропного процесса? 5. Какие группы политропных процессов вы знаете? Покажите их на pv- и Ts-диаграммах. 6. В чем физический смысл отрицательной теплоемкости? 7. В чем принципиальное различие между идеальным и реальным газами? 8. Изобразить процесс парообразования в pv- и Ts -диаграммах. 9. В чем сущность исследования термодинамических процессов любого рабочего тела? 10. Как определяют теплоту и работу изменения объема для основных термодинамических процессов идеального газа?
Тема 5.Влажный воздух
Определение влажного воздуха. Абсолютная и относительная влажности воздуха, влагосодержание. Психрометр. Температура точки росы. Энтальпия и плотность влажного воздуха. hd- диаграмма влажного воздуха.
Дата добавления: 2014-12-04; просмотров: 883;
