Методические указания. Техническая термодинамика — наука, изучающая взаимопревращения теплоты и работы и условия, при которых эти превращения совершаются наиболее эффективно
Техническая термодинамика — наука, изучающая взаимопревращения теплоты и работы и условия, при которых эти превращения совершаются наиболее эффективно. Она устанавливает взаимосвязь между тепловыми и механическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях.
Теоретическим фундаментом, на котором базируются все выводы технической термодинамики, являются первый и второй законы термодинамики, представляющие собой обобщение опыта познания человеком природы. Основная особенность метода термодинамики — логически последовательное применение аналитических выражений первого и второго законов термодинамики совместно с уравнением состояния рабочего тела, без использования каких-либо гипотез о внутреннем его строении. Этот метод оказывается эффективным как при теоретических выводах формул, так и при анализе работы различных тепловых и холодильных машин и установок. При изучении темы студент должен внимательно разобрать такие понятия, как термодинамическая система, рабочее тело и внешняя среда, равновесное и неравновесное состояния рабочего тела, термодинамический процесс.
Необходимо усвоить определения и физическую суть таких понятий, как равновесный и неравновесный, обратимый и необратимый термодинамические процессы. Понять, что равновесное состояние рабочего тела, так же как равновесный и обратимый процессы, является научной абстракцией, как некоторые идеализированные модели реальных состояний и процессов. Реальные состояния и процессы приближаются к идеализированным при условии очень малых изменений параметров состояния и когда время между последовательными изменениями состояния достаточно велико. Однако именно введение этих идеализированных понятий позволило построить стройный математический аппарат термодинамики, позволяющий получать результаты, достаточно близкие к практике.
Для усвоения последующего материала необходимо уяснить, что теплота и работа представляют собой определенные формы передачи энергии — тепловую и механическую, причем работа может переходить в теплоту, а теплота в работу, т. е. они взаимопревращаемы (тема 2).
Работа всегда полностью превращается в теплоту, в то время как переход теплоты в работу имеет определенные ограничения даже в идеальном процессе (тема 3). Взаимное превращение теплоты и работы в тепловой машине осуществляется с помощью рабочего тела, которое благодаря тепловому и механическому воздействию должно обладать способностью значительно изменять свой объем. Поэтому в качестве рабочего тела в тепловых машинах используется газ или пар. Физическое состояние рабочего тела в термодинамике определяется тремя параметрами: абсолютным давлением р, удельным объемом v и абсолютной температурой Т. Эти три параметра называются основными и связаны между собой уравнением состояния F (р, v, Т) = 0. Независимые, т.е. выбираемые произвольно, — два любых параметра, а третий определяют из уравнения состояния. Например, если р и v — независимые параметры, то T= 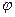 (р, v), где
(р, v), где 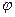 (р, v) — функция, определяемая при решении уравнения состояния относительно зависимого параметра Т.
(р, v) — функция, определяемая при решении уравнения состояния относительно зависимого параметра Т.
Для понимания физической сути изучаемых закономерностей термодинамики и принципов работы различных теплотехнических устройств нужно овладеть принципом графического изображения любых процессов, включая круговые (циклы) в термодинамических диаграммах. Необходимо уяснить, что графически можно изобразить только равновесные обратимые процессы и циклы, которые совершаются рабочим телом.
Во всех теплотехнических установках, в которых в качестве рабочего тела используют газ, он считается идеальным (ИГ), т.е. газом, состоящим из молекул — материальных точек, не имеющих размеров и между которыми отсутствуют силы взаимодействия (притяжения и отталкивания), кроме упругих соударений. Как известно из физики, такой газ подчиняется уравнению состояния Клапейрона, которое может быть записано для m кг газа (pV = mRT) и для 1 кг газа (pv = RT, где v = V/m — удельный объем газа, м3/кг).
Понятие идеального газа является научной абстракцией, моделью реального газа, дающей хорошую сходимость с практикой, когда состояние газа далеко от состояния сжижения. Применение этой модели позволяет построить достаточно простые аналитические зависимости термодинамики, применение которых к тепловым машинам дает, как правило, приемлемую сходимость с практикой.
Для насыщенного пара, т.е. для состояния, близкого к состоянию сжижения, модель идеального газа неприемлема. В этом случае приходится применять очень сложные модели и уравнения реальных газов, в которых учитывают собственные размеры молекул, а также силы взаимодействии между ними.
Уясните получение уравнения состояния Клапейрона — Менделеева для 1 моля идеального газа. Важно понять различие между удельной газовой постоянной, принимающей определенное значение для каждого газа, и универсальной газовой постоянной, одинаковой для всех газов и равной
R = 8,314 Дж/(моль-К). Запомните связь между этими газовыми постоянными и уясните физический смысл каждой из них.
При изучении газовой смеси необходимо понять, что основным здесь является умение определять газовую постоянную смеси газов, заданной массовым и объемным составом. Знание газовой постоянной смеси позволяет при исследовании термодинамических процессов пользоваться уравнением Клапейрона так же, как и для отдельного газа.
В этой теме раскрывается необходимый комплекс определений и понятий, на основе которых строится все дальнейшее изложение технической термодинамики.
Литература: [1] с. 18—40, [2] с. 5—20, 22—26, 28—32, 54—56.
Вопросы для самопроверки
1. Приведите определение термодинамической системы. 2. Что такое рабочее тело? 3. Какое число независимых параметров определяет состояние рабочего тела? Почему? 4. В чем состоит энергетическое воздействие внешней среды на рабочее тело? 5. Какой процесс называют термодинамическим? 6. Какие процессы называют обратимыми, а какие — необратимыми? 7. Какая разница между разомкнутым термодинамическим процессом и круговым (циклом)? 8. Какой газ называют идеальным? 9. Какие известны уравнения состояния идеального газа? 10. Что такое моль газа? Что называют нормальными физическими условиями? 11. Каково соотношении между удельной газовой постоянной и универсальной газовой постоянной и в каких единицах их выражают? 12. Как определяют газовую постоянную смеси идеальных газов, заданную массовыми долями? 13. Как определяют газовую постоянную смеси идеальных газов, заданную объемными долями?
Тема 2. Первый закон термодинамики
Сущность первого закона термодинамики. Внутренняя энергия. Работа процесса. Графическое изображение работы в рv-диаграмме. Теплота процесса. Принцип эквивалентности теплоты и работы. Аналитическое выражение и формулировка первого закона термодинамики. Энтальпия. Теплоемкость газов. Средняя и истинная теплоемкости, Теплоемкость смеси идеальных газов. Применение первого закона термодинамики к идеальному газу. Теплоемкость идеального газа при постоянном давлении и постоянном объеме. Энтропия. Вычисление изменения энтропии идеальных газов. Ts - диаграмма. Графическое изображение теплоты в диаграмме Ts.
Дата добавления: 2014-12-04; просмотров: 1364;
