Классификация. Стероидные алкалоиды можно разделить на две группы
Стероидные алкалоиды можно разделить на две группы. Первая группа — азотсодержащие аналоги сапонинов; они чаще всего встречаются в представителях рода паслен. Как и производные спи- ростана, гликоалкалоиды этой группы образуют нормальные (сола- содин) и изо-ряды соединений (томатидин):
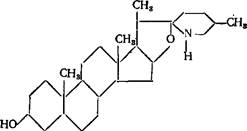 томата див
томата див
|
Вторая группа — азотсодержащие стероиды, в которых кольца Е и F сконденсированы. Эти соединения чаще всего встречаются в представителях родов паслен и чемерица. Представителем этой группы является соланидин:

|
Эта группа в свою очередь подразделяется на две подгруппы: 1) йервератровые стероидные гликоалкалоиды, молекула которых содержит до 3 атомов кислорода; к типичным представителям дан
ной подгруппы относятся йервин, рубийервин, изорубийервин, верамарин, вертицин и т. д.:
н
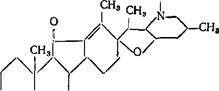 йервин
йервин
|
| «✓N/N/ |
2) цевератровые стероидные алкалоиды, в молекуле которых более 3 атомов кислорода. Основные гликоалкалоиды этой подгруппы — сабин, верацевин, термин.
§ 2. Физико-химические свойства
Стероидные алкалоиды, в основном, кристаллические вещества, хорошо кристаллизующиеся из 80%-ного .этилового спирта. Встречаются аморфные гликоалкалоиды, как, например, соланокапсидин.
Гликоалкалоиды — оптически активные соединения, имеющие определенный угол вращения. Они почти не растворяются в воде, этиловом эфире, хлороформе, растворяются в горячем этиловом спирте.
В результате наличия атома азота в агликоне стероидные алкалоиды обладают основными свойствами и могут образовывать соли. Соли большинства гликоалкалоидов — аморфные вещества, кроме кристаллического хлоргидрата соланина, температура плавления которого 212 °С (с разложением). Как и соли других алкалоидов, соли гликоалкалоидов растворимы в воде.
Стероидные алкалоиды подвергаются ферментативному и кислотному гидролизам. Щелочной гидролиз проводится редко, так как некоторые гликоалкалоиды устойчивы к щелочам. Например, соланин устойчив по отношению к щелочи, но при нагревании его с разбавленной НС1 происходит расщепление на соланидин (агли- кон) и три молекулы Сахаров: D-глюкозу, D-галактозу, L-рамнозу.
§ 3. Методы выделения
Одним из распространенных методов выделения гликоалкалоидов является кислая экстракция разбавленными кислотами с по- ледующим осаждением аммиаком. Используются разведенная серная кислота, 0,5—2%-ный раствор азотной и ортофосфорной кислот, 2%-ный раствор холодной метафосфорной кислоты, 5%-ная уксусная кислота и др. Недостаток кислотной экстракции — плохая фильтрация рыхлого осадка «сырых» гликоалкалоидов, что частично можно избежать, применяя для подщелачивания не раствор аммиака, а известковое молоко.
Экстракция подкисленными спиртами приводит к загрязнению экстрактов большим количеством сопутствующих веществ, которые затрудняют дальнейшее проведение анализа и препаративного выделения гликоалкалоидов и их агликонов.
При разделении гликоалкалоидов методом колоночной хроматографии в качестве сорбента применяют нейтральный оксид алюминия (II) и (III) степени активности по Брокману, а элюирование проводят смесью бензола с хлороформом.
Свободные агликоны хорошо разделяются на неактивном нейтральном оксиде алюминия, элюирование проводится смесью этил- ацетата и гексана в соотношении 7 : 3 по объему.
Для идентификации, и установления строения гликоалкалоидов широко используются методы УФ, ИК, ПМР спектроскопии.
§ 4. Качественное определение
Для обнаружения стероидных алкалоидов и их агликонов в растительном сырье применяются реакции осаждения и окрашивания, а также хроматографические методы анализа (тонкослойная, бумажная хроматография).
Гликоалкалоиды осаждаются холестерином, дигитонином; дают реакции окрашивания с я-оксибензальдегидом, анисовым альдегидом, резорцином, формальдегидом. Наиболее часто используется реакция Альберта (формальдегид в сильнокислой среде) — в присутствии гликоалкалоидов появляется малиново-красное окрашивание.
При обнаружении стероидных алкалоидов методом бумажной хроматографии используются различные смеси растворителей: ме- тилэтилкетон, насыщенный водой; н-бутанол — уксусная кислота — вода (10:2: 5); н-бутанол — пиридин — вода (10 : 2 : 5) и др. Для обработки хроматограмм чаще всего применяются реактив Драгендорфа (оранжевые пятна) или концентрированный хлороформный раствор треххлористой сурьмы с последующим непродолжительным нагреванием при 105 °С (кирпично-красное окрашивание).
При применении тонкослойной хроматографии в качестве сорбентов используют силикагель. Системы растворителей, также весьма разнообразны: н-бутанол — метиловый спирт — диэтиламин (17:1: 2); хлороформ — метиловый спирт — уксусная кислота (18 : 1 : 1); хлороформ — 25%-ный раствор аммиака (1000 : 1); гексан — ацетон (4:1) и др. Хроматограммы обрабатываются парами иода.
Методика качественных реакций. Приготовление извлечения: измельченное растительное сырье заливают 5%-ным раствором уксусной кислоты в соотношении 1 : 10, взбалтывают на вибраторе 40 мин, затем отфильтровывают через бумажный фильтр. К 1 мл извлечения прибавляют несколько капель 1 %-ного раствора холестерина в этиловом спирте. Образуется осадок.
§ 5. Количественное определение
Существующие методы количественного определения стероидных алкалоидов можно разделить на следующие группы.
1. Титрометрические методы. Гликоалкалоиды хорошо отти- тровываются соляной кислотой с диметиловым желтым, а также потенциометрически с сурьмяным или стеклянным электродами. Недостаток титрометрических методов — длительность промывания технических гликоалкалоидов от аммиака.
2. Методы бронирования. Гликоалкалоиды, имеющие двойную связь в положении 5, 6, могут количественно бромироваться пири- динсульфатбромидом. Этот метод пригоден только для анализа препаратов соласодина, а не растительного сырья и полупродуктов его производства.
3. «Сахарные» методы. После проведения кислого гидролиза гликоалкалоидов и осаждения агликонов проводят титрование отщепившихся Сахаров 0,1 н. перманганатом калия. Недостатком «сахарных» методов является то, что некоторые сахара могут выпадать в осадок вместе с «сырыми» гли коал кал оидами и, таким образом, завышать результаты анализа.
4. Гравиметрические метрды. Эти методы разработаны в основном для препаративных целей и часто комбинируются с колоночной хроматографией. Если метод не комбинируется с предварительным разделением на колонке, то определяется сумма гликоалкалоидов или их агликонов.. Схема метода сводится к следующему: гликоалкалоиды экстрагируют из растительного сырья разбавленным раствором H2S04 с последующим осаждением их раствором аммиака. Полученный осадок гликоалкалоидов обрабатывают кипящим этиловым спиртом и гидролизуют разбавленным раствором НС1 при кипячении. После подщелачивания агликоны исчерпывающе экстрагируют бензолом. Растворитель отгоняют, остаток высушивают при 120 °С до постоянной массы и взвешивают.
■5. Колориметрические методы. Хотя стероидные алкалоиды дают реакции окрашивания со многими альдегидами, для количественного определения применяется лишь реакция с формальдегидом в сильнокислой среде (малиново-красное окрашивание), так как окрашивание с другими альдегидами не подчиняется закону Ламберта — Бера.
Методика количественного определения соласодина в траве паслена дольчатого (Herba Solani laciniati) (OCT 64-4-118—74). Методика основана на осаждении гликоалкалоидов аммиаком из уксуснокислого извлечения с последующим потенциометриче- ским титрованием НС1.
30 г (с точностью до 0,01 г) измельченного сырья (сито № 3) помещают в плоскодонную колбу вместимостью 1,0—1,5 л и заливают 600 мл 5%-ной уксусной кислоты. Колбу с содержимым помещают на нагретую водяную баню и поддерживают внутри колбы температуру 50—60 °С в течение 4 ч при периодическом помешивании. Во избежание испарения колбу закрывают корковой пробкой, в которую вставляют термометр. Затем уксуснокислое извлечение фильтруют через воронку Бюхнера или складчатый фильтр.
200 мл прозрачного фильтрата помещают в стеклянный стакан вместимостью 400 мл, прибавляют 60 мл 25%-ного раствора аммиака и нагревают на водяной бане до температуры внутри стакана 60— 65 °С. Охлаждают' на льду в течение 2—3 ч и выпавшие технические гликоалкалоиды отфильтровывают с помощью воронки Бюхнера через двойной бумажный фильтр при слабом отсасывании или через складчатый фильтр. Остатки гликоалкалоидов из стакана количественно переносят на фильтр, смывая стакан маточником или 1 %-ным раствором аммиака. Жидкости с фильтра дают полностью стечь, после чего фильтр с гликоалкалоидами высушивают в сушильном шкафу при 80—90 °С (в развернутом виде на чашке Петри). Сухой фильтр с гликоалкалоидами помещают в колбу № 1 вместимостью 250 мл, приливают 100 мл этилового спирта и гликоалкалоиды экстрагируют при нагревании на водяной бане с обратным холодильником в течение 30—40 мин. Затем колбу снимают, эта- нольный раствор, декантируя, фильтруют через воронку с ватным тампоном в колбу № 2 вместимостью 250 мл. Этиловый спирт отгоняют на водяной бане досуха. В колбу № 1 добавляют этиловый спирт примерно до 100 мл и вновь экстрагируют 30—40 мин. Экстрагирование проводят 3—4 раза, собирая фильтраты в колбу № 2, и отгоняют каждый раз этиловый спирт досуха.
Полноту извлечения гликоалкалоидов устанавливают с помощью раствора формальдегида в серной кислоте или паров иода.
После отгонки четвертой порции остатки этилового спирта выдувают воздухом (при нагревании на водяной бане, под тягой). К сухому остатку примешивают 5—10 мл 1%-ной уксусной кислоты и растворяют гликоалкалоиды при слабом нагревании на водяной бане.
К уксуснокислому раствору гликоалкалоидов приливают 5— 10 мл 25%-ного раствора аммиака и нагревают на водяной бане до 60—65 °С. Выпавшие гликоалкалоиды охлаждают в течение 1 ч на льду, жидкость с гликоалкалоидов фильтруют декантацией через складчатый фильтр, промывая гликоалкалоиды небольшими порциями 1 %-ного аммиака. (Осадок гликоалкалоидов для лучшей промывки нужно оставлять в колбе).
Промывание проводят до тех пор, пока фильтрат не станет бесцветным. Фильтр и колбу с осадком высушивают досуха в сушильном шкафу при температуре 80—90 °С. Высушенный фильтр с осадком помещают в колбу № 2 и гликоалкалоиды растворяют при нагревании на водяной бане в 100 мл 95%-ного этилового спирта, прибавляя его небольшими порциями в колбу, и переносят раствор в стакан для потенциометрического титрования. Полученный раствор титруют потенциометрически 0,1 н. НС1. В начале титрования прибавляют по 0,5—1 мл 0,1 н. НС1, а когда разность потенциалов достигнет заметной величины — по 0,05 мл.
I .мл 0,1 н. HCI соответствует 0,04137 г соласодина. Процентное содержание соласодина в пересчете на абсолютно сухую массу сырья х вычисляют по формуле
КО,04137 • 600 100 • 100= т (100—w) 200
где V — объем 0,1 н. НС1, израсходованный на титрование, мл; т — масса навески воздушно-сухого сырья, г; w — потеря в массе при высушивании сырья, %.
Содержание соласодина в траве паслена дольчатого должно быть не менее 0,8 %.
1. Раствор формалина в H2S04 готовят смешением 10 мл концентрированной H2SO4 с 0,2 мл формалина Срок хранения не более 1 мес.
2. 2—3 капли последнего этанольного экстракта наносят на фильтровальную бумагу, высушивают и помещают в камеру с парами иода (не должно быть желтого пятна).
Реактивы и оборудование: уксусная кислота 5 и 1%-ная; аммиака раствор 1 и 25%-ный; этиловый спирт (этанол) 95%-ный; HsS04 (конц); формальдегид; иод; НС1 (0,1 н.),
Колбы плоскодонные вместимостью 1,0—1,5 л; стаканы стеклянные вместимостью 500 мл; воронки Бюхнера; колбы Бунзена; чашки Петри; колбы кругло- донные с нормальным шлифом вместимостью 250 мл; холодильники обратные стеклянные лабораторные с нормальным шлифом; установка для отгонки растворителей; стаканы для потенциометрического титрования; бани водяные лабораторные; термометр ртутный стеклянный, лабораторный; фильтры бумажные; шкаф сушильный лабораторный; медицинская резиновая груша
Методика определения содержания соласодина в траве паслена дольчатого экспресс-методом. Экспресс-метод предназначен для быстрой оценки образцов паслена для отбора селекционных образцов с содержанием соласодина выше заданного значения. Метод имеет ориентировочное значение. В дальнейшем количественными методами устанавливается точное содержание соласодина. Предварительная оценка проводится при хроматографическом разделении по размеру пятна и интенсивности окраски после проявления.
0,5 г измельченных листьев паслена (сито № 2) помещают в колбу вместимостью 25 мл, заливают 10 мл этилового спирта и экстрагируют с обратным холодильником в течение 30 мин на кипящей водяной бане. Содержимое колбы фильтруют в горячем виде через стеклянную воронку с плотным тампоном ваты в коническую колбу вместимостью 50 мл. Осадок на фильтре промывают 15 мл этилового спирта (дробно). Фильтрат количественно переносят в мерную колбу вместимостью 25 мл. Объем экстракта доводят спиртом до 25 мл, раствор перемешивают. Отбирают пипеткой из колбы 1 мл раствора и из бюретки добавляют к данной пробе 3 мл этилового спирта (рабочий раствор). Пипеткой наносят 0,005 мл рабочего раствора на пластинку «Силуфол» на расстоянии 1 см от края пластинки. На одну пластинку можно наносить несколько проб. Расстояние между точками нанесения 12—15 мад,. Диаметр пятна на старте не должен превышать 5 мм. В качестве контроля используют рабочий раствор из листьев паслена дольчатого, содержащих точно определенное количество соласодина.
Пластинку закрепляют вертикально в камере, погружая нижний край пластинки в растворитель не более чем на 1—2 мм. В качестве подвижной фазы используют систему хлороформ — метиловый спирт — вода (61 ! 32 : 7). Для лучшего насыщения с 3 сторон камеры помещают фильтровальную бумагу. Когда растворитель поднимается до верхнего края пластинки, ее вынимают и сушат в течение 5 мин в сушильном шкафу при 100 °С. Пластинку охлаждают на воздухе в течение 2—3 мин, равномерно опрыскивают 20%-ной HaS04 в этиловом спирте. Пластинку высушивают в течение 2—3 мин на воздухе и помещают в •открытый сушильный шкаф при 100 СС на 2—3 мин до появления малиновых пятен. Хроматограмму закрывают стеклом и визу- .ально сравнивают размер и интенсивность окраски пятен анализируемых и контрольных образцов. Через 20—30 мин, когда пятна начинают исчезать, хроматограмму просматривают повторно (рис. 33). Контрольный экстракт, из которого готовят рабочий раствор, можно хранить в плотно закрытой колбе в холодильнике 1 мес (если не образуется осадок).
Реактивы и оборудование: этиловый спирт (этанол) 95%-ный; метиловый спирт (метанол); хлороформ; H2S04 (конц.); вода дистиллированная
Пластинки «Силуфол»; колбы плоскодонные с нормальным шлифом вместимостью 25 мл; холодильники обратные стеклянные лабораторные с нормальным шлифом; воронки стеклянные для фильтрования диаметром 5 см; колбы конические вместимостью 25 и 50 мл; колбы мерныегвместимостью 25 мл; микропипетка измерительная вместимостью 0,01 мл; пульверизатор стеклянный герметический; камера хроматогра- фическая для ТСХ; шкаф сушильный лабораторный; бани водяные лабораторные; плитка электрическая бытовая; бюретки вместимостью 10 мл; вата гигроскопическая.
Вопросы для подготовки
Дата добавления: 2014-12-02; просмотров: 2397;
