Открытие электрона и радиоактивности. Рождение представлений о сложном строении атома
Дискретность электрического тока отражена в работах Фара-дея по электролизу — один и тот же ток приводит к выделению на электродах разного количества вещества в зависимости от того, какое вещество растворено. При выделении одного моля одновалентного вещества через электролит проходит заряд в 96 500 Кл, а при двухвалентном — заряд удваивается. После определения в конце XIX в. числа Авогадро появилась возможность оценить величину элементарного электрического заряда. Так как 6,02 • 1023 атомов переносят заряд в 96 500 Кл, то на долю одного приходится 1,2-10-19 Кл. Стало быть, это — мельчайшая порция электричества или «атома электричества». Георг Стоней предложил и назвать этот «атом электричества» электроном.
Как исследования электрических токов в металлах привели к открытию термоэлектричества и закона Ома, в электролитах — к развитию физико-химического атомизма и созданию физической химии, так в газах — к открытию электрона. Работа с токами в газах


 осложнена трудностями получения разреженной газовой среды. Немецкий механик-стеклодув Г. Гейслер изготовлял для развлечений трубки с разреженным газом, светящимся при пропускании через него электрического тока. В них В. Гиттгофф обнаружил вызывающее флуоресценцию стенок трубки излучение из катода, которое назвали катодными лучами. Как установил английский физик У. Крукс, эти лучи распространялись по прямой, отклонялись магнитным полем и оказывали механическое воздействие.
осложнена трудностями получения разреженной газовой среды. Немецкий механик-стеклодув Г. Гейслер изготовлял для развлечений трубки с разреженным газом, светящимся при пропускании через него электрического тока. В них В. Гиттгофф обнаружил вызывающее флуоресценцию стенок трубки излучение из катода, которое назвали катодными лучами. Как установил английский физик У. Крукс, эти лучи распространялись по прямой, отклонялись магнитным полем и оказывали механическое воздействие.
Французский физик Ж. Перрен поместил внутри трубки перед катодом металлический цилиндр с отверстием против катода и обнаружил, что цилиндр заряжается отрицательно. Когда лучи отклонялись магнитным полем и не попадали в цилиндр, он оказывался незаряженным. Через два года Дж.Томсон поместил цилиндр не перед катодом, а сбоку: поднесенный магнит искривлял катодные лучи так, что они попадали в цилиндр и заряжали его отрицательно, но флуоресцирующее пятно на стекле смещалось. Значит, лучи — отрицательно заряженные частицы. Такой измерительный прибор называют электронно-лучевой трубкой высокого вакуума. Под действием силы Лоренца, вызванной магнитным полем, включенным в области конденсатора, светящийся след падения пучка на экране смещается. Так в 1895 г. родилась новая наука — электроника.
Действуя одновременно электрическим и магнитным полями и меняя их величину, Томсон подобрал их так, чтобы они компенсировались, катодные лучи не отклонялись, и пятно на стекле не смещалось. Он получил отношение электрического заряда к массе частицы е/т = 1,3 • 10-7 Кл/г. Независимо от Томсона это значение измерил для катодных лучей В. Кауфман и получил близкое значение. В 1901 г. он впервые сумел измерить зависимость этой величины от скорости. В более ранних опытах, проведенных им с использованием камеры Вильсона, в которой каждый ион является центром конденсации пара и постепенно становится видимым, было получено значение заряда газообразных ионов 6,5-10-10 эл.-ст. ед. (1 Кл = 3 109 эл.-ст. ед.). Если принять, что заряд их одинаков, то масса частиц оказывалась очень малой: порядка 10-27 г. Томсон назвал эту частицу корпускулой, а электроном — только ее заряд, но потом и саму частицу катодных лучей назвали электроном (от греч. elektron — янтарь).
Открытие электрона, изучение его уникальных свойств стимулировали исследования строения атома. Стали понятны процессы поглощения и испускания энергии веществом; сходства и отличия химических элементов, их химическая активность и инертность; внутренний смысл Периодической системы химических элементов Д. И. Менделеева, природа химической связи и механизмы химических реакций; появились совершенно новые приборы, в которых движение электронов играет определяющую роль. Из-
менялись взгляды на природу материи. С открытия электрона (1897) начался век атомной физики.
Милликен поставил опыт (1909): в пространство между пластинами конденсатора впрыскивалось масло (оно испаряется медленнее воды). Проходя через горлышко пульверизатора, капельки из-за трения наэлектризовывались. В отсутствие электричества они падали медленно и равномерно; сила тяжести уравновешивалась силой сопротивления воздуха; если на пластины конденсатора подать разность потенциалов 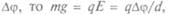 где d —
где d —
расстояние между пластинами конденсатора. Отсюда и 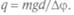 По этой формуле можно вычислить заряд капельки q из измеренных величин
По этой формуле можно вычислить заряд капельки q из измеренных величин 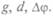 Массу капельки определяли по плотности масла и скорости установившегося течения, так как скорость такого течения в вязкой среде зависит от размера тела или капелек. При подаче напряжения движение капельки либо замедлялось, либо ускорялось в зависимости от направления поля. Диаметр капелек измеряли микроскопом. Милликен изучал поведение капелек и при воздействии на них рентгеновскими лучами. Он обнаружил, что заряды на капельках равны целому кратному некоторой основной единицы заряда, т.е. и q = Ne, где N = l, 2, 3... Если существует элементарный электрический заряд, то измеренные величины должны быть равны ему, когда к капле присоединяется один одновалентный ион, или быть в целое число раз больше — при присоединении нескольких ионов. Он измерил величину заряда на капельках масла, глицерина, ртути и получил 1,6-10-19 Кл, что совпадало с полученным значением по исследованию электролиза. Так определили удельный заряд электрона — 1,7 • 1011 л/кг, и значит, т = 9,107 • 10-31 кг, т.е. масса электрона в 1840 раз меньше массы атома водорода. Эта единица заряда фундаментальна и равна: е = 1,6 10-19 Кл.
Массу капельки определяли по плотности масла и скорости установившегося течения, так как скорость такого течения в вязкой среде зависит от размера тела или капелек. При подаче напряжения движение капельки либо замедлялось, либо ускорялось в зависимости от направления поля. Диаметр капелек измеряли микроскопом. Милликен изучал поведение капелек и при воздействии на них рентгеновскими лучами. Он обнаружил, что заряды на капельках равны целому кратному некоторой основной единицы заряда, т.е. и q = Ne, где N = l, 2, 3... Если существует элементарный электрический заряд, то измеренные величины должны быть равны ему, когда к капле присоединяется один одновалентный ион, или быть в целое число раз больше — при присоединении нескольких ионов. Он измерил величину заряда на капельках масла, глицерина, ртути и получил 1,6-10-19 Кл, что совпадало с полученным значением по исследованию электролиза. Так определили удельный заряд электрона — 1,7 • 1011 л/кг, и значит, т = 9,107 • 10-31 кг, т.е. масса электрона в 1840 раз меньше массы атома водорода. Эта единица заряда фундаментальна и равна: е = 1,6 10-19 Кл.
Примерно в это время такие же результаты получил и один из создателей русской физической школы А. Ф. Иоффе. Только вместо заряда, захваченного каплей, он измерял заряд металлической пылинки во внешнем фотоэффекте. Обнаружение электронов в радиоактивном излучении указывало на фундаментальность этих частиц. Итак, электричество имеет, как и вещество, дискретную структуру, причем во всех явлениях атомы отрицательного электричества имеют одинаковые массу и заряд. Магнитное поле катодных лучей обнаружил и измерил в 1913 г. А. И. Иоффе.
Из многочисленных опытов с пропусканием электронов через вещество Дж.Томсон заключил, что число электронов в атоме связано с величиной атомной массы. Но в нормальном состоянии атом должен быть электрически нейтрален, поскольку нейтрально вещество, состоящее из атомов, и поэтому в каждом атоме количества зарядов разных знаков равны. Поскольку масса электрона составляет примерно 1/2000 массы атома водорода, то масса положи-
тельного заряда должна быть в 2000 раз больше массы электрона. Например, у водорода почти вся масса связана с положительным зарядом. С открытием электрона сразу же появились новые проблемы. Атом нейтрален, значит, в нем должны быть другие частицы с положительным зарядом. Они еще не были открыты.
Французский физик А. Беккерель, исследуя люминесценцию, открыл (1896) явление радиоактивности. Его интересовала связь флуоресценции от катодных лучей на стенках трубки и рентгеновские лучи, испускаемые от этой части трубки. Облучая различные вещества, он пытался выяснить, могут ли рентгеновские лучи испускаться фосфоресцирующими телами, облученными солнечным светом. Соли урана (в отличие от других веществ) вызывали почернение фотопластинки и без солнечного облучения. Излучение урана ионизировало воздух, как и рентгеновское. Вскоре им занялись супруги Кюри и открыли более активный элемент, который назвали полонием в честь Польши — родины Марии Кюри. Измеряя величину эффекта, Склодовская-Кюри открыла новый элемент — радий, а сам эффект излучения назвала радиоактивностью (от лат. radio — испускаю лучи). Интенсивность излучения радия в сотни тысяч раз больше, чем у урана. Затем был открыт третий радиоактивный элемент — актиний. И произошел некий «бум» в изучении радиоактивности.
К концу 1899 г. сотрудник Дж.Томсона Э. Резерфорд заключил: «...опыты показывают, что излучение урана является сложным и состоит по крайней мере из двух различных видов: одно, быстро поглощаемое, назовем его а-излучением; другое, более проникающее, назовем его 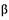 -излучением». Через три года П. Вийяр нашел еще одну компоненту излучения, которая не отклонялась магнитным полем, ее назвали
-излучением». Через три года П. Вийяр нашел еще одну компоненту излучения, которая не отклонялась магнитным полем, ее назвали 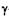 -лучами. Беккерель, супруги Кюри и Кауфман исследовали свойства выделенных излучений. Непрерывное выделение теплоты радиоактивными веществами породило проблему происхождения этой энергии — получалось, что 1 г радия выделяет почти 420 Дж за 1 ч. Остроту проблеме придавали представления классической науки, казавшиеся незыблемыми, — постоянство массы, атомное строение материи, неизменность атомов, сохранение энергии. Радиоактивность быстро находила применение в естествознании и медицине. Но уже в своей Нобелевской речи (1903) Пьер Кюри высказал опасение: «В преступных руках радий может стать весьма опасным, и мы можем задать себе вопрос, выигрывает ли человечество от знания секретов природы, достаточно ли оно созрело, чтобы пользоваться ими, не принесет ли ему вред это знание. Пример открытия Нобеля весьма характерен». Этому опасению уже 100 лет.
-лучами. Беккерель, супруги Кюри и Кауфман исследовали свойства выделенных излучений. Непрерывное выделение теплоты радиоактивными веществами породило проблему происхождения этой энергии — получалось, что 1 г радия выделяет почти 420 Дж за 1 ч. Остроту проблеме придавали представления классической науки, казавшиеся незыблемыми, — постоянство массы, атомное строение материи, неизменность атомов, сохранение энергии. Радиоактивность быстро находила применение в естествознании и медицине. Но уже в своей Нобелевской речи (1903) Пьер Кюри высказал опасение: «В преступных руках радий может стать весьма опасным, и мы можем задать себе вопрос, выигрывает ли человечество от знания секретов природы, достаточно ли оно созрело, чтобы пользоваться ими, не принесет ли ему вред это знание. Пример открытия Нобеля весьма характерен». Этому опасению уже 100 лет.
Атом переставал считаться неделимым. Идея о строении всех атомов из атомов водорода была высказана еще в 1815 г. английским врачом У. Праутом. Сомнения о неделимости атомов поро-
дили открытие спектрального анализа и Периодической системы химических элементов. Получалось, что сам атом — это сложная структура с внутренними движениями составных частей, ответственных за характерные спектры. Стали появляться и модели его строения.
Модель атома — положительный заряд распределен в положительно заряженной достаточно большой области (возможно, сферической формы), а электроны вкраплены в него, как «изюм в пудинг» — в 1902 г. предложил Кельвин. Дж.Томсон развил его идею: атом — капля пудинга положительно заряженной материи, внутри которой распределены электроны, находящиеся в состоянии колебательного процесса. Из-за этих колебаний атомы и излучают электромагнитную энергию; так он смог объяснить дисперсию света, но возникло и много вопросов. Для объяснения Периодической системы химических элементов он исследовал разные конфигурации электронов, предполагая, что устойчивым конфигурациям соответствует устройство неактивных элементов типа благородных газов, а неустойчивым — более активных. По длинам волн испускаемого атомами света Томсон оценил область, занимаемую таким атомом, — около 10-10 м. Он делал очень много предположений, увлекшись расчетом характеристик излучения по теории Максвелла, так как считал, что внутри атома действуют только электромагнитные силы. В 1903 г. Томсон получил, что электроны при движении должны излучать эллиптические волны, в 1904 г. — что при числе электронов более 8 они должны располагаться кольцами и число их в каждом кольце уменьшаться с уменьшением радиуса кольца. Число электронов не позволяет быть устойчивыми радиоактивным атомам, они выбрасывают а-части-цы, и устанавливается новая структура атома. Эксперимент Э. Ре-зерфорда, одного из учеников Томсона, привел к ядерной модели строения атома.
Открытия конца XIX в. — рентгеновских лучей (1895), естественной радиоактивности (Беккерель, 1896), электрона (Дж.Томсон, 1897), радия (Пьер и Мария Кюри, 1898), квантового характера излучения (Планк, 1900) были началом революции в науке.
Планетарная модель строения атома. Современная наука и постулаты Бора
Австрийский физик А. Гааз (1910) применил к модели Томсона квантовые идеи Планка: Е = hv. Но из-за неточности используемых в оценках величин получил значение константы Ридберга, большее в 8 раз, чем полученное впоследствии Бором. Его работу, представленную в виде диссертации, посчитали слишком наивной «карнавальной шуткой» и «провалили». Но стало понятно, что число электронов в атоме должно быть

 пропорционально атомному весу, хотя из данных по рассеянию рентгеновских лучей в легких атомах следовало, что это число в два раза меньше, а по другим опытным данным — вдвое больше. Данные о положительном заряде были не менее противоречивы: испускание а-частиц свидетельствовало о том, что они находятся внутри радиоактивных атомов. Теория модели атома Томсона (он работал над ней почти 15 лет), основанная на классических законах электричества, не устояла перед опытной проверкой и критикой.
пропорционально атомному весу, хотя из данных по рассеянию рентгеновских лучей в легких атомах следовало, что это число в два раза меньше, а по другим опытным данным — вдвое больше. Данные о положительном заряде были не менее противоречивы: испускание а-частиц свидетельствовало о том, что они находятся внутри радиоактивных атомов. Теория модели атома Томсона (он работал над ней почти 15 лет), основанная на классических законах электричества, не устояла перед опытной проверкой и критикой.
Планетарную модель строения атома первым предложил Ж. Перрен, пытаясь объяснить наблюдаемые свойства орбитальным движением электронов. Но В. Вин посчитал ее несостоятельной. Во-первых, электрон при вращении согласно классической электродинамике должен непрерывно излучать энергию и, в конце концов, упасть на ядро. Во-вторых, из-за непрерывной потери энергии излучение атома должно иметь непрерывный спектр, а наблюдается линейчатый спектр.
Опыты по прохождению а-частиц через тонкие пластинки из золота и других металлов провели сотрудники Э.Резерфорда Э.Марсден и Х.Гейгер (1908). Они обнаружили, что почти все частицы проходят через пластинку свободно, и только 1/10 000 из них испытывает сильное отклонение — до 150°. Модель Томсона это не могла объяснить, но Резерфорд, его бывший ассистент, сделал оценки доли отклонений и пришел к планетарной модели: положительный заряд сосредоточен в объеме порядка 10-15со значительной массой.
Считая орбиты электронов в атоме закрепленными, Томсон в 1913 г. тоже пришел к планетарной модели строения атома. Но, решая задачу на устойчивость такого атома с использованием закона Кулона, он нашел устойчивую орбиту лишь для одного электрона. Ни Томсон, ни Резерфорд не могли объяснить испускание а-частиц при радиоактивном распаде — выходило, что в центре атома должны быть и электроны?! Об этом говорила и М. Склодовс-кая-Кюри. Резерфорд принял это, но ему пришлось приписать электронам функцию склеивания ядер, чтобы кулоновское отталкивание не развалило ядро. Эти модели не позволяли получить количественные результаты, соответствующие опытам. В 1913 г. придали вес модели Резерфорда некоторые опытные данные по радиоактивным явлениям. Его ассистент Г. Мозли измерил частоту спектральных линий ряда атомов Периодической системы и установил, что «атому присуща некая характерная величина, которая регулярно увеличивается при переходе от атома к атому. Это количество не может быть ни чем иным, как только зарядом внутреннего ядра».
Построение теории строения атома на основе планетарной модели наталкивалось на обилие противоречий.
Сначала датский физик Н. Бор пытался применить классическую механику и электродинамику к задаче о торможении заря-
женных частиц при движении через вещество, но при заданном значении энергии электрона появлялась возможность приписывать ему произвольные параметры орбиты (или частоты), что приводило к парадоксам. Планетарная модель строения атома Ре-зерфорда оказывалась несовместимой с электродинамикой Максвелла.
В феврале 1913 г. появились статьи по интерпретации спектров звезд Дж. Никольсона. Он, распространяя идею Планка на атомы, предложил квантовать проекции момента электрона. Так появился атом с дискретными орбитами, по которым вращались группы электронов, излучающие электромагнитные волны с частотой, равной частоте обращения. Такая модель годилась для сильно возбужденных атомов, и Никольсон объяснил некоторые особенности в спектрах звезд и туманностей исходя из модели атома Нагаока — представления об электронном кольце, вращающемся вокруг положительно заряженного ядра. Атом характеризовался, в первую очередь, своим спектром излучения. Он связал со спектральными частотами частоты специально постулированных механических колебаний электронов, перпендикулярных плоскости кольца. Но тут возникли проблемы устойчивости атома, так как нужно было вводить специальные ограничения — вращающийся электрон должен двигаться где-то без излучения! (Но Никольсон до этих проблем еще не дошел.)
Теорию строения атома Бор согласовал с проблемой происхождения спектров. Он дополнил модель Резерфорда постулатами, обеспечивающими устойчивость атома и линейчатый спектр его излучения, не свойственными классической науке, в своей работе «О строении атомов и молекул». Бор отказался от представлений классической механики и обратился к квантовой гипотезе Планка: определенное соотношение между кинетической энергией в кольце и периодом обращения — это перенесение соотношения Е= hv, выражающего связь между энергией и частотой осциллятора, для системы, совершающей периодическое движение. Спектральные серии атома водорода даны на рис. 5.7, а, б. Спектральные формулы Бальмера, Ридберга и Ритца позволили сформулировать требования обеспечения устойчивости атома и линейчатого характера спектра атома водорода:
в атоме существует несколько стационарных состояний (или орбит электронов в планетарной модели), на которых атом не излучает энергии;
при переходе электрона с одной стационарной орбиты на другую атом излучает или поглощает порцию энергии, пропорциональную частоте, согласующейся с правилом частот Ридберга— Ритца.
Итак, Бор постулировал частоты и существование стационарных состояний. То, что электрон может находиться только на определенных орбитах, сразу объясняло линейчатый спектр атомов — электрон испускает свет только при переходе с одной орбиты на




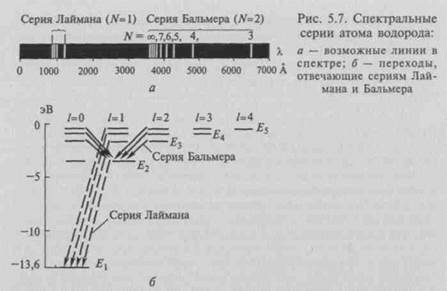
другую, т.е. дискретными порциями, и не излучает, находясь на дозволенной орбите. Правильность предположений Бора могло подтвердить только хорошее согласие с экспериментом. Постулаты Бора были радикальны, и для их восприятия научному сообществу требовалось преодолеть психологический барьер (рис. 5.8).
Применив свою теорию к строению атома водорода, Бор объяснил две (известные тогда) спектральные серии и предсказал еще две, пока не открытые. Он дал рациональное объяснение сериям спектральных линий, определил радиус атома и подсчитал значение постоянной Ридберга, входившей в комбинационный принцип Ридберга — Ритца. Это было огромным успехом. Но при переходе к более сложным атомам Бор столкнулся с трудностями: для атома гелия — только математическими, а при нескольких электронах задача оказалась сложнее, чем задача многих тел в теории Ньютона. И Бор стал строить водородоподобные модели. Теорию усовершенствовал немецкий физик А. Зоммерфельд. Из его расчетов получалось, что орбита — прецессирующий эллипс. Но такое искусственное соединение классических и квантовых представлений вело к неточным результатам для сложных атомов, не объясняло разную интенсивность линий в спектрах и т.д., хотя данные по спектрам водорода уже в 1914 г. были подтверждены.
Измерить орбиты электронов пытались в том же 1913 г. Дж. Франк и Г. Герц. Электроны вылетали из источника (электронной пушки) с энергией, определяемой ускоряющим напряжением, приложенным к двум проволочкам, проходили через газ из паров натрия, сталкиваясь с ними и искажая свои орбиты, точно так же, как звезда, проходящая вблизи планеты, исказила бы ее ор-
биту. По закону сохранения энергии это воздействие должно было бы изменить скорости электронов в выходящем из газовой камеры пучке. Оказалось, что скорость электронов в пучке почти не менялась, если их начальная энергия была меньше некоторой минимальной величины (большей в 1000 раз тепловой энергии при обычной температуре), т.е. энергию электрона нельзя изменить на произвольную величину, чего не может быть при воздействии на планетную систему.
Получалось, что атому водорода можно сообщить только 10; 12; 12,5; 12,9... эВ энергии, тогда как атому натрия — 2,1; 3,18; 3,6; 3,75... эВ и т.д.* Каждая величина энергии соответствует определенному состоянию движения электронов, а каждая линия — состоянию, которое атомы могут принимать (такие состояния назвали разрешенными квантовыми состояниями, а остальные — запрещенными). Состояние с наименьшей энергией определили как основное состояние, а остальные разрешенные — как возбужденные. Пороговая энергия равна разности между первым возбужденным и основным состояниями. Так возникло представление о квантах энергии. Ряд разрешенных значений энергии атома обычно называют его спектром. Даже из приведенных выше значений разрешенных порций энергии для атомов видно, что с ростом энергии возбуждения квантовые состояния становятся столь близкими, что почти сливаются, и квантовые эффекты исчезают. Дж. Франк и Г. Герц определили независимым образом постоянную Планка и доказали дискретность уровней энергии атомов, т.е. и модель Бора.
* В атомной физике из-за малости величин и объектов используется единица энергии электронвольт (эВ): 1 эВ = 1,6 • 10-19 Дж. Эту энергию приобретает электрон, пройдя разность потенциалов в 1 В.



 Если воспользоваться сравнением энергии с банковским счетом, предложенным В. Вайскопфом, известным физиком и популяризатором, то можно сказать, что «банк разрешает вносить вклады на счет и снимать с него только некоторые определенные суммы, чтобы держать величину вклада на одном из заранее предписанных уровней... Но странные правила, регулирующие банковский счет, не применяются к большим вкладам, потому что размеры дозволенных операций по вкладам становятся тем меньше, чем больше счет».
Если воспользоваться сравнением энергии с банковским счетом, предложенным В. Вайскопфом, известным физиком и популяризатором, то можно сказать, что «банк разрешает вносить вклады на счет и снимать с него только некоторые определенные суммы, чтобы держать величину вклада на одном из заранее предписанных уровней... Но странные правила, регулирующие банковский счет, не применяются к большим вкладам, потому что размеры дозволенных операций по вкладам становятся тем меньше, чем больше счет».
Модель Резерфорда—Бора — первая квантовая модель строения атома. Объединив в себе результаты, полученные при исследованиях радиоактивности, оптических и электромагнитных явлений, она положила начало новой эпохе в развитии теории атома и сразу же обнаружила свою плодотворность в спектроскопии и теории химической связи. Предсказание спектра атома водорода — выдающееся достижение теории и величайший триумф физики. Впоследствии установили, что электрон не может рассматриваться как материальная точка, он обладает волновыми свойствами, имеет структуру, зависящую от его состояния, а стационарных орбит не существует. Из-за волновой природы электроны и их заряды как бы размазаны по пространству атома, причем так, что электронная плотность неоднородна и имеет максимумы в определенных местах. Описание поведения электронного облака, данное в квантовой механике, становилось все более далеким от наглядности. Специфика квантово-полевых представлений заключается в вероятностной форме законов.
При очень больших значениях энергии, сообщенной атомам, они теряют свои свойства, образуя четвертое агрегатное состояние — плазму. В плазме исчезают почти все упорядочения, отличающие один атом от другого, там царит хаос. Плазма газообразного неона (на атом — 10 электронов) имеет те же свойства, что и плазма газообразного натрия с 11 электронами. Хаос таких высоких температур наблюдаем только в лаборатории, а для космоса — обычное явление. Бор показал, что для больших длин волн к формуле Бальмера можно прийти по классической электродинамике (в этой области спектра справедлива формула Рэлея—Джинса). Это положение, названное «принципом соответствия», стало методологическим основанием первоначального развития квантовой механики. В пределе, когда стационарные состояния оказываются близкими и мало отличимыми, можно пользоваться классическими представлениями. Но для развития теории этот принцип не оказал конструктивной помощи. Ван-дер-Варден назвал весь период с 1919 по 1925 г. периодом «систематического угадывания» на основе принципа соответствия. С.И.Вавилов считал, что неудача с расчетами атома гелия лишила Бора мощного орудия исследования — использования классических представлений для «почти интуитивного угадывания истинных отношений».
Дата добавления: 2014-12-27; просмотров: 1402;
