Основные положения молекулярно-кинетической теории и эмпирические газовые законы
Тела могут находиться в разных агрегатных состояниях (газообразном, жидком, твердом или в виде плазмы), но все они состоят из молекул, а молекулы — из атомов. Элементарная молекулярно-кинетическая теория газов основана на классической механике, молекулы представлены материальными точками.
Молекулярно -кинетическая теория строения вещества основана на следующих основных положениях:
1. Молекулярное строение веществ подтверждено существованием процессов растворения, диффузии, броуновского движения и др.
2. Молекулы находятся на определенных расстояниях друг от друга, что доказывается возможностью сжатия и перечисленными выше процессами. Размеры молекул газа малы по сравнению с расстояниями между ними. При отсутствии внешних сил молекулы газа равномерно заполняют весь предоставленный им объем.
3. Молекулы связаны силами молекулярного взаимодействия — притяжения и отталкивания. Силы отталкивания на малых расстояниях превосходят силы притяжения, но быстро убывают с увеличением расстояния между молекулами, и с некоторого расстояния r0, называемого радиусом молекулярного действия, ими можно пренебречь. В отсутствие внешних воздействий молекулы находятся вустойчивом состоянии на расстояниях 2r0. Эти силы имеют электромагнитную природу.
4. Молекулы находятся в непрерывном беспорядочном движении, что доказывают те же процессы.
 | |||
 | |||
|
5. Внутреннюю энергию молекулярной системы составляет сумма кинетической энергии движения молекул, потенциальной энергии их взаимодействия и всех прочих энергий этой системы.
6. В любом, даже самом малом объеме газа, к которому применимы выводы этой теории, число молекул велико.
Газовые законы были получены эмпирически для равновесного состояния:
закон Бойля—Мариотта, который выполняется при постоянной температуре Т, имеет для 1 моля идеального газа следующий вид: 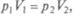 т. е. описывается изотермой на pV- диаграмме;
т. е. описывается изотермой на pV- диаграмме;
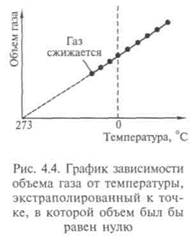
закон Гей-Люссака — изменение объема при температуре Т, постоянном давлении 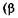 — коэффициент объемного расширения газа):
— коэффициент объемного расширения газа): 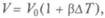 т.е. описываемом изобарой (рис. 4.4);
т.е. описываемом изобарой (рис. 4.4);
закон Шарля - изменение давления и температуры T при постоянном объеме 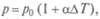 т.е. изохорный процесс. Здесь
т.е. изохорный процесс. Здесь 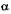 — термический коэффициент давления.
— термический коэффициент давления.
Уравнение состояния, введенное Клапейроном, для заданной массы газа объединяет три газовых закона, связывая между собой параметры газа. Клапейрон впервые употребил и графическое изображение обратимых циклических процессов, вычислив работу как соответствующую площадь на графике. Согласно закону Авогадро, количества любых газов при одинаковых температуре и давлении занимают одинаковый объем, который при нормальных условиях равен 22,4 л = 22,4 • 10-3м3. Д. И. Менделеев обобщил с учетом закона Авогадро уравнение Клапейрона: pV= 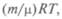 где m — масса газа; μ — его молекулярная масса; R — универсальная газовая постоянная, равная 8,31 Дж/(мольК).
где m — масса газа; μ — его молекулярная масса; R — универсальная газовая постоянная, равная 8,31 Дж/(мольК).
Газовые законы, как всякие эмпирические, справедливы приблизительно и описывают поведение почти идеальных газов при невысоких давлениях и не слишком высоких температурах. Подобных универсальных законов нет для жидкостей или твердых тел. Их свойства зависят от типа частиц, из которых они состоят, и силы взаимодействия между частицами в них меняются в широких пределах. Опыт показывает, что эти силы, имеющие отчасти характер электростатического взаимодействия, при расстояниях между молекулами более 10-9 м убывают столь быстро, что ими можно пренебречь. Поэтому свойства идеальных газов близки к свойствам реального газа.
Так как молекул много и они часто ударяются о стенку, их суммарное действие на поверхность можно заменить одной непрерывно действующей силой, которая как бы сглаживает отдельные толчки. Такое описание называется статистическим — время и место удара каждой молекулы о поверхность не интересны, важен только общий эффект, т. е. то, что входит в статистический закон.
Средняя кинетическая энергия поступательного движения молекулы газа при тепловом равновесии одинакова для всех молекул газов, находящихся в тепловом контакте. Значит, 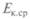 обладает основным свойством температуры и не зависит от внутренней структуры молекул. И ее можно принять за меру температуры газа или тела, находящегося в тепловом контакте с газом:
обладает основным свойством температуры и не зависит от внутренней структуры молекул. И ее можно принять за меру температуры газа или тела, находящегося в тепловом контакте с газом: 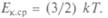
Температура газа должна определяться средней кинетической энергией его молекул. В 1730 г. Д. Бернулли наметил кинетику газовых сред. В частности, он сумел из атомистических представлений вывести закон Бойля — Мариотта. Этот закон вывел и М. В.Ломоносов — его гипотеза о внутреннем вращательном движении составляющих материю частиц позволила наглядно объяснить механизм нагревания двух трущихся друг о друга поверхностей.
Дата добавления: 2014-12-27; просмотров: 1404;
