Закон действующих масс
| Скорость химической реакции пропорциональна концентрации регулирующих веществ. Для реакции A+B=C+D |
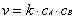 , (4)где CA и CB - концентрации вещества А и В (моль/л),k-коэффициент пропорциональности, константа скорости реакции, зависящаяот природы реагирующих веществ и от температуры.k=v, когда концентрации каждого их реагирующих равны 1 моль/л или ихпроизведение равно единице.Данное уравнение носит название кинетического уравнения реакции.
, (4)где CA и CB - концентрации вещества А и В (моль/л),k-коэффициент пропорциональности, константа скорости реакции, зависящаяот природы реагирующих веществ и от температуры.k=v, когда концентрации каждого их реагирующих равны 1 моль/л или ихпроизведение равно единице.Данное уравнение носит название кинетического уравнения реакции. 1. Зависимость скорости реакции
Согласно правилу Фант-Гоффа, при повышении температуры на каждые 10°Сскорость большинства реакций увеличивается в 2-4 раза. Число, показывающее, восколько раз увеличивается скорость данной реакции при повышении температуры на10°С, называется температурным коэффициентом реакции. Это правилоявляется приближенным.В 1889г. шведский ученый С. Аррениус предложил уравнение зависимостиконстанты скорости реакции от температуры: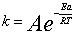 , (5)где k- константа скорости A- постоянный коэффициент, характерный для каждой реакции, R- универсальная газовая постоянная, T- абсолютная температура, Ea- энергия, названная Аррениусом энергией активации. Энергияактивации измеряется в кДж/моль.
, (5)где k- константа скорости A- постоянный коэффициент, характерный для каждой реакции, R- универсальная газовая постоянная, T- абсолютная температура, Ea- энергия, названная Аррениусом энергией активации. Энергияактивации измеряется в кДж/моль. 2. Закон Бойля-Мариотта - при постоянной температуре объем данного количества газа обратно пропорционально давлению, под которым он находится.
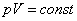 ,(6)где p-давление; V-объем газаЗакон Бойля-Мариотта выполняется при очень малых давлениях
,(6)где p-давление; V-объем газаЗакон Бойля-Мариотта выполняется при очень малых давлениях 3. Закон Гей-Люссака - при постоянном давлении изменение объема газа прямо пропорционально температуре
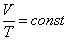 , (7) гдеT – абсолютная температура (К)
, (7) гдеT – абсолютная температура (К) 4. Закон объемных отношений - при одинаковых условиях (при неизменной температуре и давлении) объемы газов, вступающих, в реакцию, относятся друг к другу, а так же к объемам газообразных продуктов, как небольшие целые числа.
Так, 1 объем водорода и 1 объем хлора дают 2 объема хлористого водорода. 2объема водорода и 1 объем кислорода – 2 объема водяного пара, 3 объемаводорода и 1 объем азота – 2 объема аммиака.5. Закон действующих масс – скорость химической реакции пропорциональна концентрации регулирующих веществ
Для реакции A+B=C+DЗакон действующих масс запишется следующим образом: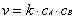 , (8) где CA и CB - концентрации вещества А и В (моль/л),k-коэффициент пропорциональности, константа скорости реакции, зависящаяот природы реагирующих веществ и от температуры.k=v, когда концентрации каждого их реагирующих равны 1 моль/л или ихпроизведение равно единице.Данное уравнение носит название кинетического уравнения реакции.
, (8) где CA и CB - концентрации вещества А и В (моль/л),k-коэффициент пропорциональности, константа скорости реакции, зависящаяот природы реагирующих веществ и от температуры.k=v, когда концентрации каждого их реагирующих равны 1 моль/л или ихпроизведение равно единице.Данное уравнение носит название кинетического уравнения реакции. 6. Зависимость скорости реакции
Согласно правилу Фант-Гоффа, при повышении температуры на каждые 10°Сскорость большинства реакций увеличивается в 2-4 раза. Число, показывающее, восколько раз увеличивается скорость данной реакции при повышении температуры на10°С, называется температурным коэффициентом реакции. Это правилоявляется приближенным. В 1889г. шведский ученый С. Аррениус предложил уравнение зависимости константы скорости реакции от температуры: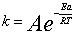 , (9) где k- константа скорости A- постоянный коэффициент, характерный для каждой реакции, R- универсальная газовая постоянная, T- абсолютная температура, Ea- энергия, названная Аррениусом энергией активации. Энергия активации - это энергия, которую необходимо сообщить частицам реагентов для того, чтобы превратить их в активные, измеряется в кДж/моль.Если при образовании продуктов реакциивыделяется больше энергии, чем было необходимо для активации выделяется большеэнергии, чем было необходимо для активации молекул, то такая реакция называется экзотермической, если меньше – то эндотермической. Для протеканияэндотермических реакций необходимо подводить энергию из вне.
, (9) где k- константа скорости A- постоянный коэффициент, характерный для каждой реакции, R- универсальная газовая постоянная, T- абсолютная температура, Ea- энергия, названная Аррениусом энергией активации. Энергия активации - это энергия, которую необходимо сообщить частицам реагентов для того, чтобы превратить их в активные, измеряется в кДж/моль.Если при образовании продуктов реакциивыделяется больше энергии, чем было необходимо для активации выделяется большеэнергии, чем было необходимо для активации молекул, то такая реакция называется экзотермической, если меньше – то эндотермической. Для протеканияэндотермических реакций необходимо подводить энергию из вне. 7. Закон Кюри
Уравнение, выражающее эту зависимость, называют законом Кюри, а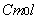
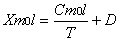 , (10)входящую в него величину
, (10)входящую в него величину 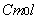 называют мольной константой Кюри;T – абсолютная температура (К); D - выражает диамагнитный вклад (он обычно отрицателен). Первый член этого уравнения можно рассчитать на основе принципа Больцмана, придопущении, что данное вещество содержит постоянные магнитные дипольныемоменты, способные ориентироваться в магнитном поле. Такой теоретическийрасчет был выполнен французским ученым Полем Ланжевеном в 1905г. Он вывелуравнение:
называют мольной константой Кюри;T – абсолютная температура (К); D - выражает диамагнитный вклад (он обычно отрицателен). Первый член этого уравнения можно рассчитать на основе принципа Больцмана, придопущении, что данное вещество содержит постоянные магнитные дипольныемоменты, способные ориентироваться в магнитном поле. Такой теоретическийрасчет был выполнен французским ученым Полем Ланжевеном в 1905г. Он вывелуравнение: 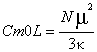 , (11) где
, (11) где  - величина дипольного магнитного момента в расчете на один атом или молекулу.
- величина дипольного магнитного момента в расчете на один атом или молекулу. 8. Закон постоянства состава вещества
| Всякое чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав. |
9. Закон сохранения массы вещества
| Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. |
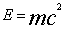 , (12)где с – скорость света в вакууме. Закон сохранения массы дает материальную основу для составления уравненийхимических реакций.
, (12)где с – скорость света в вакууме. Закон сохранения массы дает материальную основу для составления уравненийхимических реакций.
Дата добавления: 2014-12-27; просмотров: 1832;
