Фазами називають однорідні за складом і будовою частини неоднорідної системи, відокремлені від інших частин поверхнями розділення.
При цьому атоми розчинного компонента або заміщують атоми розчинника в його кристалічній ґратці, або проникають у неї.
Заміщення одних атомів іншими в кристалічній ґратці може бути необмеженим і обмеженим. Необмежене заміщення (необмежена розчинність) можливе, якщо в компонентів сплаву однакові кристалічні ґратки і невелика відмінність у розмірах атомів (до 15%), інакше заміщення атомів спричинить надмірне викривлення кристалічної ґратки розчинника і в певний момент дальша розчинність виявиться неможливою—настане границя розчинності. Для різних комбінацій металів ця границя змінюється від часток до десятків процентів. Наприклад, цинк у магнію розчиняється до 1,4, а в міді—до 39%; мідь і нікель, золото і срібло та деякі інші метали мають необмежену розчинність один в одному.
Тверді розчини проникнення утворюються звичайно при взаємодії металів і неметалів (наприклад, розчин вуглецю в залізі).
Якщо при твердінні компоненти сплаву не взаємодіють один з одним, то утворюється механічна суміш зерен кожного з компонентів. Наприклад, сплав свинцю з сурмою після твердіння являє собою суміш двох фаз—зерен свинцю і сурми. Механічна суміш деяких сплавів може складатись і з більшої кількості різних фаз; звичайно, кожна з них зберігає свій тип кристалічної ґратки.
Ряд компонентів при твердінні можуть вступати в хімічну взаємодію і утворювати хімічні сполуки як металів з неметалами, так і тільки металів.
Хімічні сполуки металів з неметалами (оксиди, сульфіди та ін.) мають особливий тип кристалічної ґратки, цілком певний склад, а також характерні фізико-механічні властивості (високу твердість, підвищену крихкість). У сплавах вони звичайно перебувають у вигляді включень.
Сполуки металів з металами характеризуються змінним складом. Наприклад, у сполуці FeCr вміст хрому може змінюватись від 20 до 60%. Недодержання закону постійності складу істотно відрізняє їх від звичайних хімічних сполук. Тому їх іноді називають не хімічними, а металевими сполуками.
Отже, фазами в сплавах бувають тверді розчини, чисті компоненти, хімічні і металеві сполуки. Комбінації цих фаз можуть утворювати різні структурні складові сплаву, які спостерігаються під мікроскопом як однотипні. Структурні складові, а отже і сплави, можна поділити на одно- і багатофазні.
§ 5. Діаграми стану подвійних сплавів
Діаграма стану I роду. Правило відрізків. Дана діаграма охоплює сплави, компоненти яких утворять суміші своїх практично чистих зерен при незначній взаємній розчинності (мал. 3.2). На осі абсцис відкладена процентна частка компонента В в сплаві.
Фазова будівля сплавів на діаграмі залежить від температури. При термодинамічному впливі компонентів один на одного знижується температура їхнього переходу в рідкий стан, досягаючи деякого мінімуму при визначеному для кожної пари компонентів складі (мал. 3.2, крапка З). Склад сплаву можна визначити, спроектувавши точку С на вісь абсцис (точка Вэ). Сплав двох компонентів, що плавиться при мінімальній температурі, називається евтектичними або евтектикою.
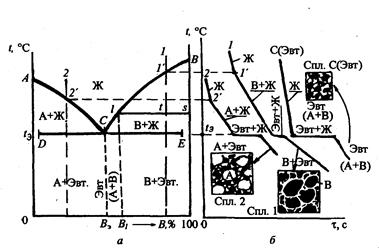
Рис. 3.2. Діаграма стану I роду (а) і схеми структур, що виходять, (б)
Евтектика є рівномірною сумішшю одночасно закристалізувалися дрібних зерен обох компонентів. Температура, при якій одночасно плавляться або кристалізуються обидва компоненти, називається евтектичною температурою tэ
На діаграмі стану температури, вище яких сплави знаходяться в рідкому стані, лежать на лінії АСВ, називаною лінією ліквідусу рис. 3.2, а) (від лат. «ліквідус» — рідкий, текучий).
Перехід сплавів з рідкого стану у тверде при кристалізації відбувається в інтервалі температур, що лежать між лінією ліквідусу і евтектичною температурою, який відповідає лінія солідуса DCE (від лат. «солідус» — твердий). При цьому з кожного сплаву в міру зниження температури у тверду фазу переходить спочатку той компонент, кількість якого перевищує евтектичною концентрацію (див. рис. 3.2, б). Тому в сплавів лівіше точки В, двухфазна зона ACD містить надлишковий компонент А и рідку фазу Ж, а в заевтектичний зоні, усі перебувають відповідно тверда В и рідка Ж фази. В обох випадках фаза Ж є рідким розчином обох компонентів.
В міру зниження температури і наближення її к/э склад незакристалізованої фази наближається до евтектичної By (рис. 3.2, точка С). При цьому чим менше сплав відрізняється за складом від евтектичного, тим нижче його точка ліквідусу і тим більше в ньому затвердіє евтектики.
Кількісні зміни в сплавах даної системи компонентів (стосовно складу твердої і рідкої фаз і їхніх часток в одиниці маси будь-якого сплаву) при кристалізації підкоряються правилу відрізків.
Скористаємося цим правилом на прикладі затвердіння сплаву (рис. 3.2). Припустимо, що нас цікавлять склад і число фаз при довільно узятій температурі, що відповідає ізотермі Its,
При даній температурі склад рідкої фази всіх заевтектичних сплавів, включаючи і сплав 1, буде однаковим, дорівнює значенню B/. Склад твердої фази буде відповідати 100% компонента В. Таким чином, при кристалізації сплавів склад рідкої фази змінюється по лінії ліквідусу від вихідного до евтектичного. Маса твердої фази при даній температурі визначається величиною відрізка lt, а рідкої — відрізка ts. Якщо масу всього сплаву Q виразити через Is, то відносні частки твердої Q, і рідкої Qж фаз можна представити у виді Qb./Q = It/Is і Q/Q = ts/ls .Користуючись цими вираженнями, можна обчислити й абсолютні масові частки кожної з фаз при будь-якій температурі.
У залежності від складу всі сплави даної системи поділяються на доевтектичні і заевтектичні. Доевтектичі сплави містять компонента А понад (100 - Вэ)%. У них він є надлишковим компонентом. У заевтектичних сплавах надлишковим є компонент В. У них його кількість перевищує Вэ.
При температурах нижче лінії солідуса фазовий склад усіх сплавів розглянутої системи складається з зерен обох компонентів: А + В. Варто розрізняти присутні в будь-якому сплаві дрібні зерна А и В, що складають евтектику, і великі зерна надлишкових фаз — компонентів А або У відповідно в доевтектичних і заевтектичних сплавах [див. схеми структур на мал. 3.2, б, що відповідають кривим охолодження сплавів 2,1 і З (Эвт.)].
Для більш точної оцінки міцністних і інших властивостей затверділих сплавів доцільно враховувати наявність евтектики в їхньому структурно-фазовому складі (мал. 3.2, б). Так, структура доевтектичних сплавів складається з А + Эвт (А + У) (див. сплав 2), а структура заевтектических — з У + Эвт (А + У) (див. сплав 1), тобто маються великі і дрібні однойменні зерна.
Кількість кожної структурної складової, від якого залежать властивості сплаву, може бути обчислене за правилом відрізків стосовно до евтектичної температури.
При оцінці міцністних і інших властивостей варто мати на увазі, що та частина сплаву, що представлена евтектикою, має більш високу міцність, чим частина, представлена більш великими зернами надлишкової фази. Характер залежності міцності сплавів від їхнього складу представлений на мал. 3.3, а. Тут у верхній частині зображена діаграма станів із указівкою фазового складу, а під нею показаний характер зміни міцності.
Якби розмір зерен у всіх структурних складових сплавів був однаковий, то міцність змінювалася б строго по лінійному законі (див. мал. 3.3, про, лінія АВ). Така зміна властивостей обумовлена законом адитивності, відповідно до якого кожна з двох фаз вносить у сумарну міцність сплаву частина своєї міцності, що відповідає долі цієї фази в сплаві.
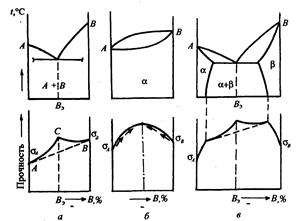
Рис. 3.3. Залежність характеру зміни міцності сплавів від роду діаграми стану
У зв'язку з цим міцність будь-якого сплаву а може бути обчислена по формулі про = т|етд + (1 - т|)стд, де t| — частка фази А в структурі сплаву; ста і <Тв — міцності фаз А и В.
Оскільки евтектична частина сплаву має більш високу міцність, фактична зміна цієї властивості буде відбуватися по кривій АСВ (мал. 3.3, о).
Аналогічно з урахуванням їх характеру й у залежності від складу змінюються й інші властивості сплавів. Такий характер зміни властивостей розглянутих сплавів під дією прикладеної сили порозумівається тим, що в даному випадку повна реакція сплаву на зовнішній вплив складається з реакцій зерен обох фаз.
Діаграма станів II роду. Дендритна ліквація. При необмеженій розчинності компонентів друг у другу, що мають однакові типи ґрат і подібна будівля зовнішніх електронних оболонок, одержують діаграми П роду. На діаграмі можна розрізнити три фазові області (мал. 3.4, а).
1. Вище лінії ліквідусу АСВ знаходиться область рідкої фази Ж.
2. Під нею до лінії солідуса ADB розташована двохфазна область а + Ж. Фаза а являє собою твердий розчин компонентів А и В.
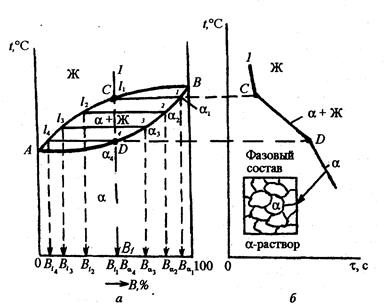
Рис. 3.4. Діаграма стану II роду (а); характер кристалізації сплавів і схема їхньої фазової будівлі (б)
Зерна цієї фази мають єдині кристалічні ґратки. Однак у сплавів різного складу число атомів компонентів А и В в елементарних осередках ґрат по-різному.
3. Область, розташована під лінією солідуса, є однофазною (фаза а).
На відміну від сплавів сумішей зерен практично чистих компонентів кожний із затверділих сплавів на розглянутій діаграмі стану являє собою сукупність зовні нічим не відрізняються друг від друга зерен фази а (мал. 3.4, б).
Кристалізація а-фаз у сплавах різного складу відбувається відповідно до правила відрізків. Якщо простежити специфіку кристалізації якого-небудь зі сплавів, наприклад сплаву 1 (мал. 3.4), то відповідно до правила відрізків у двохфазній зоні склади рідкої і твердої фаз у залежності від температури змінюються відповідно по лініях ліквідусу і солідуса (мал. 3.4, а, ізотерми 1,2,3 і 4). Склади рідкої фази від крапки l1 до l44 виражаються через Вl =B1, Вl2 , Вl3 і Вl4 , а склади твердої фази а змінюються від Вa1 , Вa2 , Вa3 до Вa4 = B1.
Кількість співіснуючих при кожній з температур фаз а і Ж визначається відповідними відрізками ізотерм. Причому відрізки, що знаходяться ліворуч від вертикалі 1, визначають кількість фази а. Довжини відрізків, що знаходяться праворуч, пропорційні кількості фази Ж.
У випадку рівноважної кристалізації, що відбуває при досить малій швидкості охолодження сплаву, до кінця кристалізації (ізотерма 4) склад остаточно сформувався фази a4 повинний відповідати вихідному складові сплаву B1 (у даному випадку сплаву 1). Це обумовлено безупинно відбувається дифузією між обома фазами.
У випадку прискореного охолодження сплаву при кристалізації дифузійні процеси не встигають завершитися. У зв'язку з цим центральна частина кожного зерна виявляється збагаченої більш тугоплавким компонентом (у даному випадку В), а периферійна — легкоплавким компонентом (А). Це явище називається дендритною ліквацією, що знижує міцністні й інші властивості сплавів. Її запобігання можливе за рахунок повільного охолодження сплаву, що забезпечує його рівноважну кристалізацію.
У випадку виникнення дендритної ліквації вона може бути усунута шляхом тривалого, так називаного дифузійного, відпалу сплаву. При цьому дифузійні процеси вирівнюють хімічний склад у зернах.
У сплавів — твердих розчинів — міцність і інші властивості в залежності від складу змінюються по криволінійному законі (див. мал. 3.3, б). Щоб зрозуміти характер зміни міцності сплавів у залежності від складу, необхідно усвідомити наступне.
Під час пластичної деформації металевого матеріалу зовнішня сила повинна перебороти опір пересуванню дислокацій, обумовлений значенням сили Пайерлса-Набарро. Ця сила залежить від інтенсивності міжатомної взаємодії в кристалічних ґратках сплаву.
Атоми розчинного компонента утворять у ґратах твердого розчину більш міцний металевий зв'язок з атомами компонента-розчинника, чим у ґратах обох чистих компонентів. Через цього опір пластичної деформації твердого розчину зі збільшенням змісту розчиненого в ньому іншого компонента повинне зростати по якомусь криволінійному законі. Характер ходу кривій з максимумом на мал. 3.3, б стане зрозумілим, якщо виходити з того, що в сплавах ліворуч від максимуму ґратами, що піддаються зміцненню, є ґрати компонента А, а праворуч — ґрати компонента В. Склад, що відповідає максимумові, є критичним, оскільки ролі компонентів як розчинників і розчинних міняються на протилежні.
Мотт і Набарро установили залежність між границею текучості сплаву — твердого розчину ст„ його складом, модулем зрушення G і розмірами атомів компонентів: ст,. = 0€'с, де з — атомна концентрація розчиненого компонента; е = ——°- — параметр, що залежить від атомних радіусів компонентів (м і го — радіуси атомів розчинного компонента і розчинника).
У випадку рівноважної кристалізації, що відбуває при досить малій швидкості охолодження сплаву, до кінця кристалізації (ізотерма 4) склад остаточно сформувався фази a4 повинний відповідати вихідному складові сплаву B1 (у даному випадку сплаву 1). Це обумовлено безупинно відбувається дифузією між обома фазами.
У випадку прискореного охолодження сплаву при кристалізації дифузійні процеси не встигають завершитися. У зв'язку з цим центральна частина кожного зерна виявляється збагаченої більш тугоплавким компонентом (у даному випадку В), а периферійна — легкоплавким компонентом (А). Це явище називається дендритною ліквацією, що знижує міцністні й інші властивості сплавів. Її запобігання можливе за рахунок повільного охолодження сплаву, що забезпечує його рівноважну кристалізацію.
У випадку виникнення дендритної ліквації вона може бути усунута шляхом тривалого, так званого дифузійного, відпалення сплаву. Дифузійні процеси вирівнюють хімічний склад у зернах.
У сплавів — твердих розчинів — міцність і інші властивості в залежності від складу змінюються по криволінійному законі (див. мал. 3.3, б). Щоб зрозуміти характер зміни міцності сплавів у залежності від складу, необхідно усвідомити наступне.
Під час пластичної деформації металевого матеріалу зовнішня сила повинна перебороти опір пересуванню дислокацій, обумовлений значенням сили Пайерлса—Набарро. Ця сила залежить від інтенсивності міжатомного взаємодії в кристалічних ґратах сплаву.
Атоми розчинного компонента утворять у ґратах твердого розчину більш міцний металевий зв'язок з атомами компонента-розчинника, чим у ґратах обох чистих компонентів. Через цього опір пластичної деформації твердого розчину зі збільшенням змісту розчиненого в ньому іншого компонента повинне зростати по якомусь криволінійному законові. Характер ходу кривій з максимумом на мал. 3.3, б стане зрозумілим, якщо виходити з того, що в сплавах ліворуч від максимуму ґратами, що піддаються зміцненню, є ґратки компонента А, а праворуч — ґратки компонента В. Склад, що відповідає максимумові, є критичним, оскільки ролі компонентів як розчинників і розчинних міняються на протилежні.
Мотт і Набарро установили залежність між границею текучості сплаву — твердого розчину Стт, його складом, модулем зрушення G і розмірами атомів компонентів: сг,. = GElc, де з — атомна концентрація розчиненого г-г, компонента; е = ——- — параметр, що залежить від атомних радіусів компонентів (м і ro — радіуси атомів розчинного компонента і розчинника).
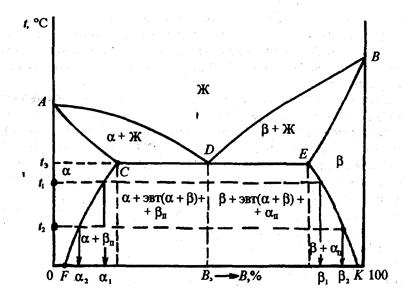
Рис. 3.5. Діаграма станів III роду
Діаграма станів III роду характерна для сплавів, що утворяться при сплавці компонентів, що мають обмежену розчинність друг у другу.
Розглянемо випадок, коли за межами розчинності компонентів утворяться механічні суміші твердих розчинів на основі кожного з них (мал. 3.5). На діаграмі станів представлена: рідка фаза Ж (вище лінії ліквідусу ADB); дві області (а + Ж) і (Р + Ж) ( щолежать між лініями ліквідусу і солідуса АСЕВ); дві області обмежених твердих розчинів а і Р ( що лежать нижче відрізків лінії солідуса, відповідно АС і BE) і двохфазна зони (а + р) — область CEKF.
Фаза а є твердим розчином компонента В в А. Фаза р являє собою твердий розчин компонента А в В. Взаємна розчинність компонентів друг у другу, як правило, залежить від температури. Криві CF і ЕК відбивають характер зміни розчинності в залежності від температури відповідно компонента В в а-фазі і компонента А в Р-фазе).
Склади фаз при будь-якій температурі можна визначити, опустивши на вісь концентрацій перпендикуляри з відповідних крапок, що лежать на лініях CF і ЕК. При /I і t2 склади фаз а і ?: а,, а; і Pi, Pz.
У структурно-фазовому складі сплавів даної системи важливе місце займає евтектика, що представляє собою суміш дрібнозернистих фаз а і ?. Вона має визначений склад і кристалізується при найменшій для даної системи температурі tý тобто на лінії СЕ. Нижче цієї лінії знаходиться область двохфазних сплавів. У ній структура доевтектичних сплавів складається з первинних зерен α-фази, рівномірно розподілених у евтектиці Э (а + Р), і зерен вторинної Рп-фази, що виділилася з твердої фази ос при зниженні температури.
Заэвтектические сплави відповідно складаються з первинної Р-фази, евтектики і зерен вторинної фази аII.
Для з'ясування характеру обумовленого зниженням температури розпаду фаз а і Р, що супроводжується виділенням фаз рII і aII, помітимо, що в доевтектических сплавах у результаті неминучого приїхньому охолодженні розпаду наявної в них р-фази (у евтектиці і рII) також утвориться і вторинна α-фаза (aII). Однак на діаграмі станів це не вказується, тому що при виділенні фаза аII зливається з навколишніми її зернами первинної фази а і як самостійна структурна складова не спостерігається. Те ж можна сказати про рII в заевтектических сплавах.
На мал. 3.3, у показаний характер зміни міцності сплавів розглянутої системи в залежності від складу. Як і випливало очікувати, в однофазних областях твердих розчинів а і Р властивості змінюються по криволінійному законі, а в двохфазної області (а + р) — за законом адитивності з урахуванням впливу наявної в сплавах дрібнозернистої евтектики (див. мал. 3.3, в).
Подібним чином змінюються й інші властивості сплавів, охоплюваних діаграмою станів III роду. Характер зміни властивостей сплавів у залежності від складу відбиває рівень властивостей рівноважних сплавів, що володіють мінімальною щільністю дислокації (106— 107 див-2) і ідеальною металургійною якістю.
Діаграма стані IV роду відноситься до випадку, компоненти, що коли сплавляються, при співвідношенні Вn, Вn утворять стійка хімічна сполука, не дисоціює при нагріванні аж до температури плавлення. У зв'язку з цим його правомірно розглядати як самостійний компонент, здатного утворювати сплави з кожним з вихідних компонентів.
З'єднання Амвn, при сплавленні з компонентами А и В у залежності від їхньої природи може утворювати з ними різні по характері системи Наприклад (мал. 3.6), компонент Амвn утворить з компонентами А и В сплави, що відносяться до діаграми станів I роду. У зв'язку з цим фазовий склад будь-якого сплаву системи В у твердому стані повинний представляти суміш хімічної сполуки й одного з вихідних компонентів.
Рівень властивостей сплавів і характер їхньої зміни в залежності від складу в цьому випадку повинні змінюватися за законом адитивності (див. мал. 3.3, а) з урахуванням впливу евтектики.
Характер зміни властивостей сплавів у залежності від складу визначається діаграмою стану. На це положення вперше серйозно увагу звернув академік Н. С. Курнаков, внесено фундаментальний внесок у методику вивчення властивостей сплавів.
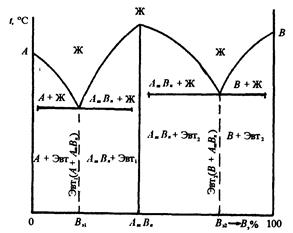
Рис. 3.6. Діаграма станів IV роду
Висновок по теорії сплавів. Усвідомивши основні положення теорії сплавів, неважко зрозуміти, що можна створювати сплави різного призначення, цілеспрямовано закладаючи в них такі фактори, що дозволять на наступних етапах технологічної обробки формувати в сплавах необхідні дислокаційно-фазові структури і необхідні комплекси механічних і інших властивостей. Цьому будуть сприяти зведення, які можна одержати з аналізу діаграм станів.
У зв'язку з цим особливу цінність представляють такі зведення, як поводження сплавів при наявності або відсутності вних перемінної розчинності компонентів або алотропічних перетворень при зміні температури.
Дуже важливо чітко усвідомити описані вище характер і причини зміни властивостей сплавів у залежності від типу діаграми станів. Хоча ці властивості і відносяться до рівноважного стану, однак додатковою обробкою їхній можна цілеспрямовано змінювати. Причому зміна стосується тільки рівня властивостей, а характер зміни, як правило, зберігається «діаграмний».
Особливо важливо підкреслити положення, відповідно до якого в кристалічних ґратках твердих розчинів інтенсивність міжатомної взаємодії значно вище, ніж у ґратках складових їхніх компонентів. У зв'язку з цим утворяться високостабільні фази з підвищеною міцністю (наслідок зрослих сил Пайерлса-Набарро), більш високим опором корозії (утрудняється виривання атомів з поверхні деталі дією агресивного середовища) і уповільненими дифузійними процесами через зрослу енергію активації. Усе це має визначальне значення при створенні легованих сталей і сплавів різного цільового призначення.
| Навчальне питання 4 Поняття про будову металів та сплавів. |
Дата добавления: 2014-12-26; просмотров: 2192;
