Работа №50. Получение и свойства йодида водорода.
| Необходимые принадлежности и реактивы: пробирки с газоотводной трубкой, капельная воронка, йод (крист.), красный фосфор, лакмус, цинк, магний, ацетат натрия, ацетат свинца, мрамор, нитрат серебра, фосфорная кислота (60%). |
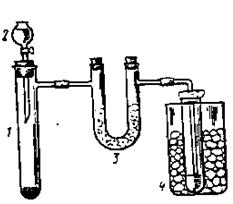
| 1. Собрать прибор (рис.44) (вытяжной шкаф!). Положить в пробирку 1 2 г йода и 0,5 г красного фосфора. В капельную воронку 2 налить несколько мл воды. В пробирку 4 налить 3-5 мл воды. Отверстие отводной трубки должно находиться возможно ближе к поверхности воды приемника. Почему нельзя его опустить в воду? Осторожно спустить из капельной воронки одну каплю воды и наблюдать что происходит. После того как закончится бурно |
| Рис. 44. Прибор для получения иодида водорода |
протекающая реакция, можно вновь спустить воду из капельной воронки 2.
Когда в пробирку 1 будет введена вся вода, то пробирку следует подогреть. Какой газ выделяется? Хорошо ли он растворим в воде? Написать уравнения реакций.
Полученный раствор испытать на лакмус. Изучить его отношение к металлам (цинк, магний). Налить в три пробирки по 1мл раствора йодида водорода и добавить в первую пробирку раствор уксуснокислого натрия и уксуснокислого свинца, во вторую - 1-2 кали раствора азотнокислого серебра, в третью положить небольшой кусочек мрамора (карбонат кальция). Что происходит? Написать уравнения реакций для всех процессов.
2. В пробирку поместить немного йодида калия, добавить к нему концентрированной (60%-ной) фосфорной кислоты и слабо подогреть. Какой выделяется газ? Написать уравнение реакции и объяснить ее течение.
Можно ли заменить фосфорную кислоту серной? Проделать соответствующий опыт и написать уравнение реакции.
Какой из галогеноводородов является наиболее сильным восстановителем? Расположить галогеноводороды в ряд по их прочности. Объяснить изменение устойчивости молекул галогеноводородов в зависимости от размеров ионных и атомных радиусов галогенов. Каковы величины диполей молекул галогеноводородов (см. учебник)?
Работа №51. Изучение восстановительных свойств галогенид-ионов.
| Необходимые принадлежности и реактивы: диоксид свинца, сурик (Pb3O4), соляная кислота (конц.), бромид калия, бензол, йодид калия, серная кислота ) конц.), хлорид железа (III), крахмал . |
1. Поместить в пробирку немного диоксида свинца или сурика. Добавить концентрированный раствор соляной кислоты и нагрейте. Какой газ выделяется? Написать уравнение реакции.
2. К раствору бромида калия прибавить несколько капель серной кислоты, перманганата калия и несколько капель бензола. Встряхнуть содержимое пробирки. Объяснить, что наблюдается.
3. К нескольким каплям раствора йодида калия прибавить осторожно несколько капель концентрированного раствора серной кислоты. Какое вещество выделяется? Написать уравнение реакции.
4. К раствору хлорида железа (III) прибавить 2-3 капли крахмала и раствор йодида калия. Что происходит? Написать уравнение реакции.
Как изменяются восстановительные свойства галогенид-ионов в ряду F-, Cl, Br-, I-? Закончиье уравнения следующих реакций?
NaF + H2SO4конц. =
NaCl + H2SO4конц. =
NaBr + H2SO4конц. =
NaI + H2SO4конц. =
Чем объяснить различное течение процессов при действии концентрированной серной кислоты на соли галогеноводородных кислот?
Дата добавления: 2014-12-26; просмотров: 1777;
