ДИФФУЗИОННО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ГЕТЕРОГЕННОГО РЕАГИРОВАНИЯ
В технологии урана большую роль играют процессы, протекающие на границе раздела двух фаз. В любом случае гетерогенные процессы из ряда последовательных или параллельных стадий. На поверхности раздела любых гетерогенных реакций возникает образование диффузионного (пограничного или двойного электрического) слоя. Диффузионный слой образуется, когда в состав обеих фаз входят заряженные частицы (ионы, электроны, молекулы). Диффузионный слой, состоящий из неподвижной газовой пленки, существует между твердым веществом и газом или между жидкостью и газом. Диффузионный слой, состоящий из неподвижной жидкостной пленки, имеет место между двумя несмешивающимися жидкостями, а твердый диффузионный слой – между двумя твердыми веществами (слой продуктов реакции, постепенно возрастающий со временем).
Итак, для того, чтобы произошел элементарный химический акт необходимо проникновение вещества через диффузионный слой.
При анализе гетерогенных процессов выделяют две принципиально различающиеся ситуации.
В первом случае – скорость химической реакции велика и превышает скорость диффузионных стадий. Процесс лимитируется скоростью диффузии. Тогда для увеличения производительности нужно стремиться к устранению тормозящего влияния диффузионных стадий. Этот случай соответствует диффузионной области протекания гетерогенного процесса.
Другая ситуация характеризуется тем, что скорость химической реакции при данном режиме осуществления процесса мала по сравнению со скоростью диффузионных стадий. Интенсификация гетерогенного процесса в целом может быть достигнута при таком изменении технологического режима, которое приведет к интенсификации химической стадии. Такие гетерогенные процессы принято называть процессами, протекающими в кинетической области.
Взаимодействие между твердым телом и газом складывается из следующих стадий:
1. Перенос газа к поверхности твердого тела (молекулярная и конвективная диффузия).
2. Сорбция (хемосорбция) газа на поверхности твердого тела.
3. Химическая реакция между сорбированным газом и твердым веществом.
4. Кристаллизационные процессы (разрушение кристаллической решетки исходных веществ и образование новой кристаллической решетки продуктов реакции, в случае образования твердых продуктов реакции). В случае образования газообразных продуктов реакции – перенос газообразных продуктов реакции из глубины твердых продуктов реакции к поверхности твердой частицы.
5. Десорбция газообразных продуктов реакции с поверхности твердой фазы.
Взаимодействие между твердым телом и жидкостью складывается из следующих стадий:
1. диффузия реагирующих молекул к внешней поверхности;
2. адсорбция на поверхности;
3. реакция на поверхности;
4. десорбция продуктов реакции;
5. диффузия продуктов от поверхности.
В результате протекания гетерогенной химической реакции в разных точках реакционного пространства устанавливаются различные концентрации реагирующих веществ и продуктов реакции. Градиент концентраций более подвижного реагента является причиной возникновения диффузии – самопроизвольного процесса переноса вещества в результате движения молекул до установления равновесного распределения концентраций. Хаотичное тепловое движение частиц вещества вызывает упорядоченный направленный перенос его в области, где возникают градиенты концентрации или где распределение концентраций отличается от равновесного.
Скорость диффузии зависит от плотности и вязкости среды, температуры, природы диффундирующих частиц, воздействия внешних сил и т. д. Закономерности диффузионных процессов описываются законами Фика.
Согласно первому закону Фика количество вещества А, перенесенного за счет диффузии в единицу времени через поверхность S, перпендикулярную направлению переноса, пропорционально градиенту концентрации этого вещества в данный момент времени t:
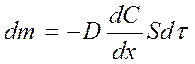 (58)
(58)
Коэффициентом пропорциональности D называется коэффициентом молекулярной диффузии; его единицы измерения (длина)2(время)-1, например см2/с.
В общем случае концентрация меняется как в пространстве, так и во времени. Изменение концентрации вещества во времени в результате молекулярной диффузии описывается вторым законом Фика:
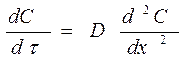 (59)
(59)
или для диффузии в трехмерном пространстве:
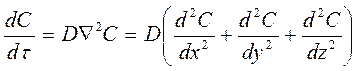 (60)
(60)
Выразим скорость диффузии используя уравнение (58)
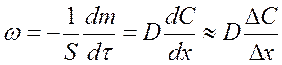 (61)
(61)
где DС – изменение концентрации на расстоянии Dx = d - толщины слоя, через который проходит диффузионный поток.
Тогда:
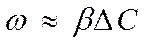 (62)
(62)
где b - коэффициент пропорциональности (коэффициент массотдачи),
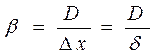 (63)
(63)
Коэффициент молекулярной диффузии является функцией молекулярных свойств того вещества, которое диффундирует, и того вещества, в котором происходит диффузия первого. Коэффициент диффузии слабо возрастает с ростом температуры и уменьшается с ростом давления. Чаще всего коэффициент D определяют по опытным данным, а также по эмпирическим или полу эмпирическим зависимостям.
Дата добавления: 2014-12-26; просмотров: 1642;
