ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ
В самом начале развития органической химии появились теории, в которых делались попытки понять строение органических соединений.
Теория радикалов. Гей-Люссак и Берцелиус в 1815 г. показали, что в органических соединениях существуют устойчивые группировки атомов, радикалы, которые могут переходить при реакциях из одного соединения в другое без изменения.
Теория типов. Лоран и Жерар в 1853 г. выявили аналогию в строении и некоторых свойствах органических и простейших неорганических соединении. Например, спирты были отнесены к типу воды, то есть рассматривались как продукты замещения водорода в воде НОН радикалом RОН, амины – к типу аммиака, углеводороды – к типу водорода.
В 1857 г. Кекуле сделал вывод о четырехвалентности атома углерода в органических соединениях, а Купер выдвинул положение о наличии углеродных цепей и предложил черточки для обозначения химических связей. Однако одному и тому же веществу в зависимости от типа его реакций приписывались различные формулы. Так, ацетону приписывались 4 различные формулы, уксусной кислоте – 8 и т.д.
Теория химического строения, которой мы сейчас пользуемся, разработана А.М.Бутлеровым, профессором Казанского, а затем Петербургского университетов.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ БУТЛЕРОВА:
1. Положение о химическом строении.
Молекулы органических соединений имеют определенное химическое строение, под которым понимают последовательность соединения атомов друг с другом в соответствии с их валентностью. Химическое строение вещества можно установить, изучая реакции его разложения или синтеза в мягких условиях и выразить его структурной формулой, например, для этана:
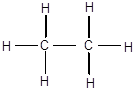
или сокращенной структурной формулой, где черточки ставятся только между атомами углерода: СН3-СН3.
При составлении структурных формул необходимо учитывать основные особенности атома углерода:
a) углерод, как правило, четырехвалентен;
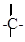
b) атомы углерода могут соединяться друг с другом, образуя цепи: открытые неразветвленные,
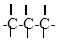
открытые разветвленные
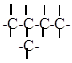
c) циклические
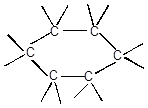
d) углерод может затратить на соединение с другим атомом одну, две, три единицы валентности, образуя при этом простую связь:
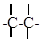
двойную связь:

тройную связь: -С 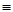 С-;
С-;
e) углерод может соединяться как с металлами, так и с неметаллами.
Дата добавления: 2014-12-24; просмотров: 763;
