Примеры сильных и слабых кислот и оснований
| Кислоты | Основания | |||
| Сильные | Средней силы | Слабые | Сильные | Слабые |
| HCL | H3PO4 | HCN | Гидроксиды щелочных металлов (KOH, NaOH, ZiOH), Ba(OH)2 и др. | Na4OH и нерастворимые в воде основания (Ca(OH)2, Zi(OH)2, AL(OH)3 и др. |
| HBr | H2SO3 | HNO2 | ||
| HI | HP | H2CO3 | ||
| HNO3 | H2S | |||
| H2SO4 | CH3COOH | |||
| HMnO4 | HCIO | |||
| HCLO4 |
Константа гидролиза равна отношению произведения концентраций
продуктов гидролиза к концентрации негидролизованной соли.
Пример 1. Вычислить степень гидролиза NH4Cl.
Решение: Из таблицы находим Кд(NH4ОН)=1,8∙10-3, отсюда
Кγ=Кв/Кдк= =10-14/1,8∙10-3= 5,56∙10-10.
Пример 2. Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе.
Решение: Ионное уравнение гидролиза Zn2 + H2O 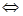 ZnOH+ + H+
ZnOH+ + H+
KдZnOH+1=1,5∙10-9; hγ=√(Кв/ [Кдосн∙Cм]) = 10-14/1,5∙10-9∙0,5=0,36∙10-2 (0,36%).
Пример 3.Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение: а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН — сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN- + Н2О 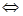 HCN + ОН-
HCN + ОН-
или в молекулярной форме
KCN + Н2О 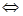 HCN + КОН
HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО-3 , а не молекулы Н2СО3, так как ионы НСО-3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO2-3+H2O 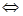 HCO-3 +ОН-
HCO-3 +ОН-
или в молекулярной форме
Na2CO3 + Н2О 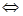 NaHCO3 + NaOH
NaHCO3 + NaOH
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOН+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + Н2О 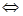 ZnOН+ + Н+
ZnOН+ + Н+
или в молекулярной форме
2ZnSO4 + 2Н2О 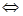 (ZnOH)2SO4 + H2SO4
(ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 4.Какие продукты образуются при смешивании растворов A1(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О 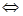 А1ОН2+ + Н+
А1ОН2+ + Н+
СО2-3 + Н2О 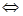 НСО- з + ОН-
НСО- з + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + ЗСО2-3 + ЗН2О = 2А1(ОН)3 + ЗСО2
молекулярное уравнение: ЗСО2 + 6KNO3
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3
Дата добавления: 2014-12-24; просмотров: 2286;
