Ионная связь
При полном смещении межъядерной электронной плотности к атому с большей электроотрицательностью длина диполя становится равной длине связи (ℓ=α), и атомы превращаются в положительно и отрицательно заряженные ионы, между которыми действуют силы электростатистического притяжения. Такую связь называют ионной. Степень полярности или ионности связи i определяется отношением ℓ/α, крайние значения которого 0 и1 соответствуют чисто ковалентной и чисто ионной связям. В остальных случаях эта величина имеет промежуточные значения, например, для молекулы НСl : α= 0,128 нм и ℓ = 0,0225 нм, откуда i = ℓ/α = 0,0225/0,1280 = 0,18 или точнее 0,20 (при учете влияния НР атома Сl). Таким образом, ионность связи Н-Сl составляет 20%, а эффективные заряды атомов δ +0,2 и -0,2 заряда электрона.
Чем больше разность электроотрицательностей ΔЭО для данной пары атомов, тем больше длина диполя и величина эффективных зарядов, а следовательно, тем больше и ионность связи:
| Cоединения | NaF | ZiF | NaCl | HF | HI |
| ΔЭО | 3,1 | 3,0 | 2,1 | 1,9 | 0,3 |
| Ионность , % | |||||
| Ковалентность,% |
Полного, т.е. 100%-ного, смещения электронной плотности на атом с большей ЭО не происходит даже в наиболее ионных соединениях, которыми являются бинарные соединения щелочных металлов с галогенами. Это объясняется как волновыми свойствами электронов, так и влиянием зарядов образовавшихся ионов на электронные оболочки друг друга, т.е. их взаимной поляризацией. Принято считать связь ионной, если ΔЭ0 > 1,9. Значения μ ионных молекул лежат в пределах 1,33∙10-30 Кл∙м.
Отрицательное сродство атомов ко второму электрону делает невозможным существование простых многозарядных ионов (О2- , N3- и т.д). Однако реально существуют многозарядные сложные ионы (SO42- , PO43- и др.). Это объясняется делокализацией их зарядов, в результате которой эффективный заряд каждого атома, входящего в состав иона, не превышает заряда электрона, равного -1.
Ионная связь, в отличие от ковалентной, характеризуется :
1. ненаправленностью, так как сферическое поле вокруг ионов во всех направлениях равноценно;
2. ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной компенсации их силовых полей;
3. координационными числами в ионных соединениях, которые определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов. Так, отношение
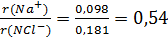
Это значение лежит в пределах 0,41 – 0,73, что определяет октаэдрическую координацию ионов, которая характеризует кристаллическую решетку хлорида натрия.
Дата добавления: 2014-12-24; просмотров: 862;
