Условие равновесия изолированной двухфазной однокомпонентной системы.
В качестве примера на определение конкретных условий равновесия, исходя из общих условий равновесия, рассмотрим изолированную двухфазную систему одного итого де вещества. Например, вода и ее пар. Для такой системы 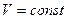 ,
, 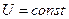 ,
, 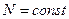 .
.
Если 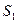 и
и 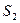 энтропия соответственно первой и второй фаз, то энтропия системы
энтропия соответственно первой и второй фаз, то энтропия системы 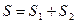 . Ее общее условие равновесия
. Ее общее условие равновесия 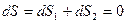 .
.
Каждая из фаз представляет собой однокомпонентную систему с переменным числом частиц, и основными уравнениями термодинамики для них будут:
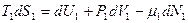 и
и 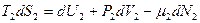 определим
определим 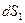 и
и 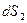 . Подставим в условие равновесия
. Подставим в условие равновесия
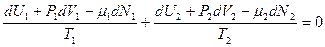 ,
,
а т.к. система изолирована, то ее параметры подчиняются следующим уравнениям связи, в качестве независимых параметров выберем 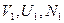 ;
;
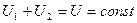 ,
, 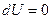 Þ
Þ 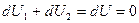 Þ
Þ 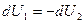 ;
;
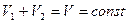 ,
, 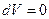 Þ
Þ 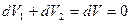 Þ
Þ 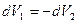 ;
;
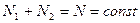 ,
, 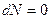 Þ
Þ 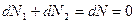 Þ
Þ 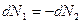 ;
;
изменение одной из компонент, например, 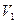 приводит к такому же изменению с обратным знаком объема
приводит к такому же изменению с обратным знаком объема 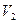 другой компоненты и т.д.
другой компоненты и т.д.
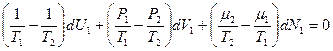 , отсюда в следствии независимости вариаций окончательно получаем следующие частные условия фазового равновесия однокомпонентной системы, т.е.равенство всех ТД сил в обеих фазах:
, отсюда в следствии независимости вариаций окончательно получаем следующие частные условия фазового равновесия однокомпонентной системы, т.е.равенство всех ТД сил в обеих фазах:
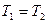 - равенство температур фаз (условие термического равновесия);
- равенство температур фаз (условие термического равновесия);
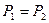 - равенство давлений в фазах (условие механического равновесия);
- равенство давлений в фазах (условие механического равновесия);
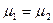 - равенство химических потенциалов вещества в фазах (условие химического равновесия).
- равенство химических потенциалов вещества в фазах (условие химического равновесия).
Эти три условия можно записать в виде одного - 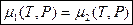 , условия равенства химических потенциалов вещества в фазах при одинаковых температуре и давлении.
, условия равенства химических потенциалов вещества в фазах при одинаковых температуре и давлении.
Условие фазового равновесия показывает, что при равновесии двух фаз одного и того де вещества давление является функцией температуры, параметры 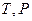 перестают быть независимыми.
перестают быть независимыми.
Полученные условия фазового равновесия или справедливы только для однородных фаз, при отсутствии поля внешних сил. Если же фаза находится во внешнем поле (например, в поле сил тяжести), то при равновесии в обеих фазах одинаковы лишь температуры. Давление же и химический потенциал в каждой фазе является функциями координат.
8. Принцип Ле Шателье-Брауна.
Устойчивость состояния обеспечивается тем, что при выводе системы из состояния равновесия в ней возникают факторы, стремящиеся вернуть ее в состояние ТД равновесия. Это положение было установлено Ле Шателье и обосновано Брауном и носит название принцип Ле Шателье-Брауна. Принцип позволяет предсказать направление, в котором под влиянием внешнего воздействия изменится ТД процесс, протекающий в произвольной системе.
Принцип Ле Шателье-Брауна: если на систему, находящуюся в устойчивом ТД равновесии, воздействуют внешние факторы, стремящиеся вывести ее из этого состояния, то в системе возникают процессы, стремящиеся уничтожить изменения, вызываемые внешними воздействиями.
Математически принцип выражается неравенством 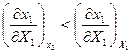 , где в системе сохраняется химический состав и масса,
, где в системе сохраняется химический состав и масса, 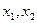 - параметры, определяющие состояние системы,
- параметры, определяющие состояние системы, 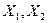 - обобщенные силы, соответствующие этим параметрам. Если в системе, в которой поддерживаются постоянными параметры
- обобщенные силы, соответствующие этим параметрам. Если в системе, в которой поддерживаются постоянными параметры 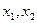 , мы начинаем внешним воздействием
, мы начинаем внешним воздействием 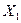 изменять параметр
изменять параметр 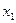 , то это вызовет изменение
, то это вызовет изменение 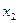 и
и 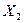 , а мерой воздействия является величина
, а мерой воздействия является величина 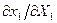 . Но при внезапном увеличении
. Но при внезапном увеличении 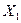 происходящий процесс вначале можно рассматривать как при постоянном
происходящий процесс вначале можно рассматривать как при постоянном 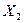 , следовательно, в это время приложенное воздействие характеризуется производной
, следовательно, в это время приложенное воздействие характеризуется производной 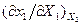 . Когда же снова наступит равновесие и параметр
. Когда же снова наступит равновесие и параметр 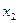 примет поддерживаемое внешней средой прежнее значение, то изменение величины
примет поддерживаемое внешней средой прежнее значение, то изменение величины 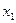 за счет внешнего воздействия будет определяться производной
за счет внешнего воздействия будет определяться производной 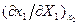 . Принцип утверждает, что в новом равновесном состоянии, в которое переходит система, изменение параметра
. Принцип утверждает, что в новом равновесном состоянии, в которое переходит система, изменение параметра 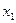 ослаблено за счет внешнего воздействия.
ослаблено за счет внешнего воздействия.
Примеры проявления принципа Ле Шателье-Брауна:
1. Увеличим внешнее давление на тело, уменьшая его объем. При этом возникает изменение температуры, которое направлено так, что стремится снова увеличить объем; поэтому те тела, которые от нагревания сжимаются (например, вода при 4°С), будут от сжатия охлаждаться.
2. Сообщим смеси из льда и воды некоторое количество теплоты. Тогда лед начинает таять, благодаря чему не происходит повышение его температуры, которое иначе имело бы место.
3. Если имеются два вещества в состоянии химического равновесия и им сообщили некоторое количество теплоты, то произойдет та реакция, которая охлаждает систему. Следовательно, при повышении температуры будут разлагаться вещества, возникающие путем экзотермической реакции, и, наоборот, будут возникать эндотермические соединения.
4. Для соли, находящейся в насыщенном растворе, повышение температуры вызывает растворе, если последнее связано с охлаждением; в противном случае происходит выпадение кристаллов.
5. Если электрический ток проходит через спай двух металлов, то температура спая изменяется в таком направлении, что возникающей термоэлектрический ток стремится ослабить ток, пропускаемый через спай (явление Пельтье).
Из примеров видно, что принцип Ле Шателье-Брауна обусловлен устойчивостью состояния. Если бы первичный процесс усиливался еще дальше благодаря вызванному им вторичному процессу, то это привело бы к полному расстройству равновесия в системе.
Дата добавления: 2019-10-16; просмотров: 584;
