ТД базируется на 2 постулатах и 3 началах.
I постулат ТД: всякая изолированная макросистема с течением времени приходит в состояние ТД равновесия, и самопроизвольно выйти из него не может.
II постулат ТД: все равновесные внутренние параметры являются функциями внешних параметров и температуры.
I начало ТД: говорит о том, что энергия сохраняется, оно обобщает закон сохранения энергии для макросистем, для молекулярных форм движения вещества.
II начало ТД: устанавливает наличие в природе фундаментальной ассиметрии, однонаправленности всех происходящих в ней самопроизвольных процессов. Горячие тела охлаждаются, а холодные не становятся нагретыми. Прыгающий мяч останавливается, а покоящийся самопроизвольно не подскакивает. Здесь проявляется свойство природы, что хотя полное количество энергии должно сохраниться в любом процессе, распределение имеющейся энергии изменяется необратимым образом.
III начало ТД: утверждает невозможность охлаждения вещества до температуры абсолютного нуля. Оно очевидным образом предполагает атомное строение вещества.
Второй постулат ТД приводит к существованию функциональных соотношений, называемых уравнения состояния, устанавливающих связь между внешними параметрами, температурой и каким-либо внутренним параметром состояния макросистемы. Т.е. параметры системы не могут принимать произвольное значение. Для любой системы они связаны некоторым функциональным соотношением.
Если этим внутренним параметром является внутренняя энергия 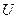 , то уравнение называется калорическим уравнением состояния.
, то уравнение называется калорическим уравнением состояния.
Если внутренним параметром является какая-либо обобщенная сила, то уравнение называется термическим уравнение состояния.
Общее число термических и калорического уравнений состояния системы равно числу ее степеней свободы, т.е. числу независимых параметров, характеризующих состояние системы. Если все эти уравнения состояния известны, то с помощью начал термодинамики можно определить все термодинамические свойства системы.
Вывести сами уравнения состояния на основе начал ТД нельзя. Для каждой конкретной системы они определяются эмпирически, т.е. берутся из опыта, или находятся методами статистической физики. Так что в рамках ТД они считаются заданными при определении системы.
До сих пор не существует удовлетворительной общей теории уравнений состояния, кроме случаев особых простых систем: идеального газа и совершенных кристаллов. Для жидкостей и твердых тел соотношения между параметрами состояния до сих пор получают эмпирически.
Ограничимся рассмотрением простых систем, систем с постоянным числом частиц, состояние которых определяется только одним внешним параметром и температурой.
Термическое уравнение состояния такой системы, записанное в общем виде:
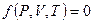 .
.
Калорическое уравнение состояния, записанное в общем виде:
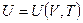 .
.
Например:
для идеального газа уравнение состояния (термическое) - это уравнение
Менделеева-Клапейрона 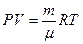 ;
;
для модели реального газа уравнение состояния - это уравнение Ван-дер-Ваальса
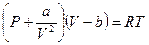 - для одного моля вещества.
- для одного моля вещества.
Если известны два параметра, то третий находится из уравнения состояния
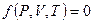 .
.
Например: 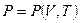 ,
, 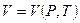 ,
, 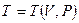 .
.
Уравнение состояния изображается в условном пространстве 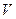 ,
, 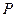 ,
, 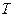 поверхностью состояний. Каждой точке такой поверхности соответствует определенное состояние данной системы, и наоборот, точке не лежащей на поверхности не соответствует никакое состояние этой системы. Если мы отметим точками на поверхности состояний, все промежуточные состояния, в которых будет находиться система при совершении квазистатического процесса перехода из начального состояния в некоторое конечное состояние, то, полученная линия, отразит путь перехода от начального состояния в конечное. Таких путей перехода может быть бесконечное множество.
поверхностью состояний. Каждой точке такой поверхности соответствует определенное состояние данной системы, и наоборот, точке не лежащей на поверхности не соответствует никакое состояние этой системы. Если мы отметим точками на поверхности состояний, все промежуточные состояния, в которых будет находиться система при совершении квазистатического процесса перехода из начального состояния в некоторое конечное состояние, то, полученная линия, отразит путь перехода от начального состояния в конечное. Таких путей перехода может быть бесконечное множество.
В ряду параметров выделяются величины, которые так же характеризуют состояние системы и меняются с изменением состояния, т.е. зависят от 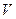 ,
, 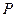 ,
, 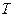 . Но эти величины, зависят только от состояния, и, не зависят от того пути, по которому система пришла в это состояние. Они дают более полные сведения о системе и называются функциями состояния.
. Но эти величины, зависят только от состояния, и, не зависят от того пути, по которому система пришла в это состояние. Они дают более полные сведения о системе и называются функциями состояния.
Величины, независящие от предыстории, а полностью определяющие состояние системы в данный момент называются функциями состояния, т.е. функциями 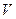 ,
, 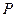 ,
, 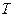 .
.
Дата добавления: 2019-10-16; просмотров: 425;
