Радикальная сополимеризация
Радикальную сополимеризацию обычно инициируют теми же способами, что и радикальную гомополимеризацию. Для неё, в принципе, характерны те же механизмы роста, обрыва и передачи цепи. Рассмотрим сополимеризацию двух мономеров. Предполагая, что активность радикалов роста определяется лишь типом концевого звена, следует учитывать четыре элементарные реакции роста:
Таблица 12.1.1.
Элементарные реакции роста цепи

где Мi— мономер i-ого типа; ~R∙j— макрорадикал, оканчивающийся звеном Mj, а kij— константа скорости присоединения Мjмономера к радикалу ~R∙i. Рассматриваемая модель получила название "модель концевого звена" сополимеризации. Кинетическая обработка приведенной реакционной схемы в квазистационарном приближении позволяет установить связь между составом сополимеров и составом исходной смеси мономеров. В квазистационарном состоянии концентрации радикалов ~R∙1и ~R∙2 постоянны, т.е. скорости перекрестного роста цепи равны между собой:

(12.1.1)
Скорости превращения мономеров при сополимеризации описываются уравнениями:

(12.1.2)
Из отношения скоростей этих реакций с учетом условия стационарности для концентраций радикалов (12.1.1) несложно получить следующее выражение, обычно называемое уравнением Майо-Льюиса, характеризующее на начальных стадиях превращения, когда без большой ошибки можно положить концентрации мономеров [M1] и [M2] величинами постоянными, зависимость состава получаемого сополимера от состава мономерной смеси:
 (12.1.3)
(12.1.3)
 |  |
где , а так называемые константы сополимеризации. Они представляют собой отношения констант скоростей присоединения к данному радикалу "своего" и "чужого" мономеров. Значение r1 и r2 зависят от химической природы реагирующих мономеров.
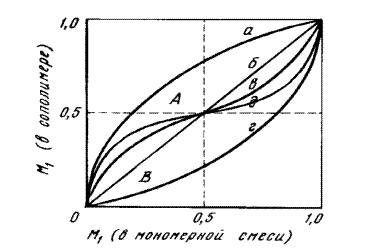
Рис. 12.1.1. Зависимость состава сополимера от состава смеси мономеров.
Зависимость состава сополимеров от состава смеси мономеров удобно характеризовать диаграммой "состав мономерной смеси - состав сополимера" (рис. 12.1.1.). Форма кривых на диаграмме составе зависит от значений r1 и r2. При этом возможны следующие случаи: 1) r1=r2=1, т.е. для всех соотношений концентраций мономеров в реакционной смеси состав сополимера равен составу исходной смеси (прямая б), 2) r1>1 и r2<1, т.е. для всех соотношений концентраций мономеров в исходной смеси сополимер обогащен звеньями М1 (кривая а), 3) r1<1 и r2>1, т.е. для всех исходных соотношений концентраций мономеров сополимер обогащен звеньями М2 (кривая г), и наконец, 4) r1<1 и r2<1, т.е. при малых содержаниях M1 в исходной смеси мономеров сополимер обогащен звеньями М1, а при больших — звеньями M2 (кривые в и д). В последнем случае наблюдается склонность к чередованию в сополимере звеньев М1 и М2, которая тем больше, чем ближе к нулю значения r1 и r2. Случай r1>1 и r2>1, которому должна соответствовать тенденция к раздельной полимеризации мономеров в смеси, обычно на практике не реализуется.
Величины r1 и r2 могут быть определены экспериментально. Знание их позволяет предсказать состав сополимера и распределение мономерных звеньев в цепях при любом соотношении мономеров в смеси. Значения r1 и r2 при радикальной сополимеризации и, следовательно, состав сополимера обычно слабо зависят от природы растворителя и очень мало меняются с температурой.
Рассмотрение величин r1 и r2 в рамках теории идеальной радикальной реакционной способности приводит к заключению, что r1*r2=1, т.е. константы скоростей присоединения одного из мономеров к обоим радикалам в одинаковое число раз больше констант скоростей присоединения другого мономера к этим радикалам. Имеется ряд систем, для которых это условие хорошо оправдывается на опыте. В таких случаях мономерные звенья обоих типов располагаются в макромолекулах случайно. Однако для многих систем r1*r2<1. Это отклонение связано с влиянием полярных и пространственных факторов, которые обусловливают тенденцию мономерных звеньев М1 и М2 к чередованию в макромолекулах. В таблице в качестве примеров приведены значения констант сополимеризации и их произведений для некоторых пар мономеров.
Таблица 12.1.2.
Константы радикальной сополимеризации некоторых мономеров.
| М1 | М2 | r1 | r2 | r1r2 |
| Стирол | Бутадиен | 0,80 | 1,40 | 1,12 |
| Стирол | Метилметакрилат | 0,52 | 0,46 | 0,24 |
| Стирол | Винилацетат | 55,0 | 0,01 | 0,55 |
| Стирол | Малеиновый ангидрид | 0,01 | ||
| Винилацетат | Винилхлорид | 0,23 | 1,70 | 0,39 |
| Метилакрилат | Винилхлорид | 9,0 | 0,08 | 0,75 |
12.2. "Схема Q - е" Алфрея – Прайса
Учет полярных факторов был сделан в рамках полуэмпирической схемы, называемой схемой "Q-е", в которой принимают, что
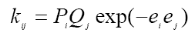 (12.2.1)
(12.2.1)
где Рi и Qj — параметры, соответствующие энергиям сопряжения в мономере (j) и радикале (i), согласно теории идеальной радикальной реакционной способности. Величины еi и еj учитывают поляризацию реагирующих мономеров.
 Тогда:
Тогда:
(12.2.2)
(12.2.3)
Используя эту схему, удалось оценить относительную реакционную способность мономеров и роль полярных факторов для большого числа пар сополимеризующихся мономеров. За стандартный мономер был принят стирол со значениями Q=1, е = −0,8. При сополимеризации стирола с другими мономерами (Mj) последние были охарактеризованы своими значениями Qj и еj, что дало возможность предсказать поведение этих мономеров в реакциях сополимеризации с другими мономерами, для которых также были установлены значения Q и е. Хотя схема "Q-е" не имеет полного теоретического обоснования, с практической точки зрения она оказалась полезной. Значения Q и е большинства мономеров собраны в справочной литературе.
Дата добавления: 2019-07-26; просмотров: 1004;
