Круговороты газообразных веществ
Круговороты газообразных веществ, в которых, например, углекислый газ, веществ азот, кислород, благодаря наличию крупных атмосферных или океанических (или тех и других) фондов достаточно быстро компенсируют возникающие нарушения. Например, избыток СО2, обсуловленный интенсивным окислением, горением или промышленными выбросами в каком- либо районе, обычно быстро рассеивается с воздушными потоками. Кроме того, излишки СО2 компенсируются усиленным фотосинтезом и превращением их в гидрокарбонаты в море: СО2 + Н2О + СаСО3 Са(НС03)2. Таким образом, круговороты газообразных веществ с большими резервными фондами имеют мощные буферные системы в глобальном масштабе и хорошо приспособлены к изменениям. Однако способность к саморегуляции даже при таком резервном фонде, как атмосфера и океан, конечно, не беспредельна.
Биогеохимические циклы углерода и азота - примеры круговоротов наиболее важных газообразных биогенных веществ.
Круговорот углерода. Сейчас запасы углерода в атмосфере в виде СО2 относительно невелики в сравнении с его запасами в океанах и земной коре (в виде ископаемого топлива).
Вспомним, как образовалась современная земная атмосфера с низким содержанием углекислого газа и высоким содержанием кислорода. Когда более 2 млрд лет назад появилась жизнь, атмосфера Земли, подобно современной атмосфере Юпитера и других планет, состояла из вулканических газов. В ней было много СО2 и мало (или совсем не было) кислорода. Первые организмы были анаэробными, т. е. жили в отсутствие кислорода. В результате того что первичная продукция в среднем превышала расходы органических веществ на дыхание, в атмосфере стал появляться О2.
Накопление кислорода началось с докембрия, и к началу палеозоя его содержание в атмосфере не превышало 10 % от современного. В дальнейшем оно подвергалось значительным флуктуациям, но неуклонно росло. Предполагают, что в истории Земли были периоды, когда концентрация кислорода превышала современную. Сейчас наличный запас свободного кислорода оценивается приблизительно в 1,6-1015 т. Современные зеленые растения могут воссоздать такое количество за 10 000 лет. Накоплению кислорода, по-видимому, способствовали также геологические и физико-химические процессы: высвобождение его из оксидов железа, восстановление кислородсодержащих соединений азота, расщепление воды ультрафиолетовыми лучами и др. Содержание же СО2 до мелового периода в 6 - 10 раз превышало современный уровень, а затем неуклонно падало.
Циркуляция углерода в биосфере основана на поступлении СО2 в атмосферу и его потреблении.
Поступление углекислого газа в атмосферу в современных условиях происходит в результате: 1) дыхания всех организмов; 2) минерализации органических веществ; 3) выделения по трещинам земной коры из осадочных пород (имеют также биогенное происхождение); 4) выделения из мантии Земли при вулканических извержениях (незначительная часть - до 0,01 %); и 5) сжигания топлива.
Потребление углекислого газа происходит главным образом: 1) в процессе фотосинтеза; 2) в реакциях его с карбонатами в океане; 3) при выветривании горных пород (рис. 4.3).
.
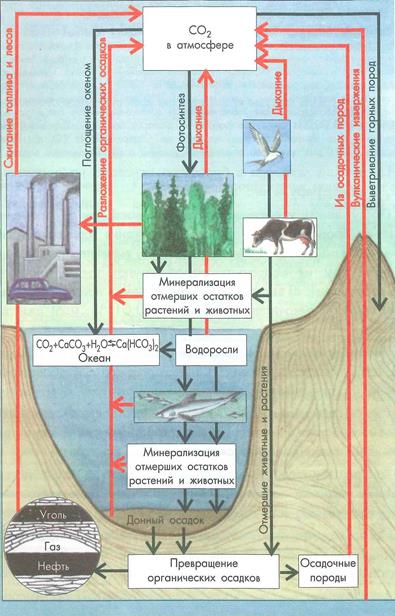
Рисунок 4.3 – Биотический круговорт углерода
Низкое содержание СО2 и высокие концентрации О2 в атмосфере сейчас служат лимитирующими факторами для фотосинтеза, а зеленые растения являются регуляторами этих газов.
Таким образом, «зеленый пояс» Земли и карбонатная система океана поддерживают относительно постоянное содержание СО2 в атмосфере.
Полагают, что до наступления индустриальной эры потоки углерода между атмосферой, материками и океанами были сбалансированы.
Влияние человека на круговорот углерода проявилось в том, что с развитием индустрии и сельского хозяйства поступление СО2 в атмосферу стало расти за счет антропогенных источников.
Основная масса углерода находится в земной коре в связанном состоянии. Важнейшие минералы углерода - карбонаты, количество углерода в них оценивается в 9,6 1015 т. Разведанные запасы горючих ископаемых (угли, нефть, битумы, торф, сланцы, газы) содержат около 1*1013 т углерода.
Главная причина увеличения содержания СО2 в атмосфере - это сжигание горючих ископаемых, однако, свой вклад вносят и транспорт, и уничтожение лесов.
Сельское хозяйство также приводит к потере углерода в почве, так как фиксация СО2 из атмосферы агрокультурами в течение лишь части года не компенсирует полностью высвобождающийся из почвы углерод, который теряется при окислении гумуса (результат частой вспашки).
При уничтожении лесов содержание углекислого газа в атмосфере увеличивается при непосредственном сжигании древесины, за счет снижения фотосинтеза и при окислении гумуса почвы (если на месте лесов распахивают поля или строят города). Леса - важные накопители углерода: в биомассе лесов приблизительно в 1,5, а в лесном гумусе - в 4 раза больше углерода, чем в атмосфере.
Современное изменение ландшафта человеком заметно повлияло на поток углерода из резервного фонда в обменный. Одновременное уменьшение поглотительной способности «зеленого пояса» может привести к сбою механизмов саморегуляции и природного контроля. Содержание СО2 в атмосфере уже сейчас начинает возрастать. В начале промышленной революции, примерно в 1800 г., в атмосфере Земли содержалось около 290 частей СО2 на миллион (0,029 %). В 1958 г. содержание СО2 составляло 0,0315 %, а в 1980 г. выросло до 0,0335 %. Если содержание углекислого газа в атмосфере вдвое превысит доиндустриальный уровень (приблизится к 0,06 %), что может произойти в конце следующего столетия, то вероятно потепление климата на 1,5- 4,5 С. Наряду с подъемом уровня моря (в этом веке он уже поднялся примерно на 12 см) и перераспределением осадков, эти изменения могут привести к затоплению прибрежных районов. Так называемые проблемы СО2 («парниковый эффект») должны учитываться при планировании национальной и международной энергетической и экономической политики. Правда, предполагают, что в следующем веке может установиться новое (но ненадежное) равновесие между увеличением количества СО2 и запыленностью атмосферы частицами, отражающими тепловое излучение. Но любое результирующее изменение теплового бюджета Земли все равно повлияет на климат.
Кроме СО2, в атмосфере присутствуют в небольших количествах еще два углеродных соединения: оксид углерода СО (около 0,1 млн -1) и метан СН4 (около 1,6 млн -1). Как и СО2, они находятся в быстром круговороте: время пребывания в атмосфере СО - около 0,1 года, для СН4 - 3,6 года, а для СО2 - 4 года. В естественных условиях СО и СН4 образуются при неполном анаэробном разложении органических веществ и в атмосфере окисляются до СО2. Количество СО, попадающего в атмосферу при сгорании топлива, особенно с выхлопными газами, равно его естественному поступлению.
Оксид углерода - смертельный яд для человека. В глобальном масштабе его количество не представляет угрозы, но в городах концентрация этого газа достигает 100 млн1, т. е. в 1000 раз больше естественного содержания, и становится угрожающей, особенно в районах с сильным автомобильным движением. Для сравнения приведем такие данные: курильщик (пачка сигарет в день) получает столько СО, сколько он получил бы, дыша воздухом с содержанием СО 400 млн-1. Это уменьшает содержание оксигемо-глобина в его крови на 3 % и приводит к анемии и другим заболеваниям, связанным С гипоксией (гр. hypo- низкое, oxi - кислород): ишемической болезни, стенокардии, другим сердечно-сосудистым заболеваниям. Следовательно, вдыхание СО в насыщенных автотранспортом городах сопоставимо с его количеством, поступающим в кровь при курении табака.
Круговорот азота. Воздух по объему почти на 80 % состоит из молекулярного азота N2 и представляет собой крупнейший резервуар этого элемента.
Поступление азота в атмосферу происходит: 1) в процессе денитрификации, т. е. биохимического восстановления оксидов азота до молекулярного газа N2; 2) с вулканическими газами и 3) с «индустриальными вулканами» (дымом, выхлопными газами). В водоемы соединения азота поступают: с поверхностным и дренажным стоком с городских и сельских территорий; с подземными водами; с городскими и промышленными стоками; со сточными водами сельскохозяйственных производств.
Поступление азота из воздуха происходит: 1) в процессе азотфиксации благодаря деятельности азотфиксирующих бактерий и многих водорослей (прежде всего синезеленых), 2) в результате естественных физических процессов фиксации азота в атмосфере (электрические разряды при грозе и др.) и 3) в процессе промышленного синтеза NH3.
Минеральные соединения азота (NH4+, N02, N03) потребляются растениями при фотосинтезе. Животные, поедая растения, используют азот для построения белков протоплазмы, превращая его в органические формы (рис. 4.4).
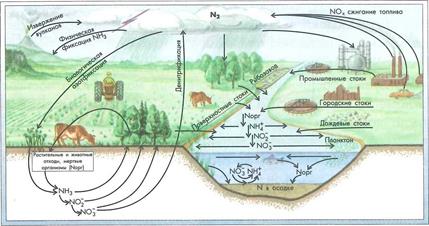
Рисунок 4.4-Биотический круговорот азота
Биотический круговорот азота включает ряд очень сложных процессов, основную роль в которых играют микроорганизмы.
Проиллюстрировать эти процессы можно на примере распада наиболее сложных высокомолекулярных азотсодержащих органических веществ - белков. Распад белков идет в несколько стадий.
На первой стадии происходит расщепление белков до аминокислот микроорганизмами, вырабатывающими ферменты протеазы:
БЕЛКИ -> ПЕПТОНЫ -> ПОЛИПЕПТИДЫ -> АМИНОКИСЛОТЫ.
На второй стадии аминокислоты (RCHNH2COOH) разлагаются бактериями, актиномицетами, грибами как в аэробных, так и в анаэробных условиях:
Поскольку продуктом разложения аминокислот независимо от путей расщепления является аммиак NH3, то эта стадия называется аммонификацией.
В результате белкового обмена в животных организмах выделяется мочевина CO(NH2)2, которая тоже служит источником NH3:
CO(NH2)2 + Н20 = 2NH3 + СО2
При аммонификации могут образовываться также сероводород H2S, индол C2H7N, скатол C9H9N, этилмеркаптан C2H5SH. Все эти вещества обладают неприятным резким запахом, поэтому распад белков часто называют гниением.
Далее, выделившийся аммиак в природных условиях частично используется растениями как питательный материал, а частично окисляется, взаимодействуя с кислородом. Эта стадия превращений азота называется нитрификацией и протекает в две фазы в процессе жизнедеятельности нитрифицирующих бактерий.
В первой фазе аммиак окисляется до азотистой кислоты (или нитритов):
2NH3 + 3О2 = 2HNO2, + 2Н2О + Q
во второй фазе азотистая кислота окисляется до азотной (или до нитратов):
2HNО2 + О2 -> 2HNQ3 + Q,
Нитрификация в первой фазе осуществляется в основном нитрификаторами из рода Nitrozomonas, а во второй - из рода Nitrobocter. В изучение этого процесса большой вклад внес русский микробиолог С. Н. Виноградский (1856 - 1932). Один из возбудителей нитрификации носит его имя - Nitrobacter Winogradsky. Он открыл также некоторые азотфиксирующие бактерии. Реакции нитрификации идут с выделением энергии, которую бактерии используют для своей жизнедеятельности, т. е. они являются хемоавтотрофами.
Образовавшиеся при нитрификации нитриты и нитраты могут быть потенциальным источником кислорода в анаэробных условиях.
Денитрификация протекает с потреблением энергии за счет жизнедеятельности бактерий, в основном, из рода Pseudomonas и Micrococcus.
В сточных водах, особенно при биологической очистке, в процессе нитрификации часто образуются излишние количества нитритов и нитратов, которые могут вызывать нежелательное «цветение» воды в водоемах. Поэтому процессы денитрификации используются для глубокой доочистки сточных вод от минеральных форм азота. В данном случае человек стремится возвратить в круговорот излишки азота, образующиеся при принудительном разложении органических веществ на очистных сооружениях.
Азотфиксация (связывание молекулярного азота) - процесс, обратный денитрификации. Оба процесса требуют энергии, которую микроорганизмы получают либо в виде солнечного света, либо в виде органического вещества.
Долгое время считалось, что фиксировать N2 атмосферы могут немногие, но широко распространенные в природе микроорганизмы, а именно: бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений - Rbizobium, синезеленые водоросли Anabaena, Nostoc и др. Затем было обнаружено, что многие водные и почвенные бактерии также обладают этой способностью. Кроме того, оказалось, что примитивные грибы (актиномицеты) в клубеньках ольхи и некоторых других деревьев (около 160 видов) фиксируют N2 не менее эффективно. В отличие от бобовых, эти фиксаторы приспособлены к бедным песчаным или болотистым почвам, где доступного для растений азота мало. Поэтому ольха, например, может увеличивать продукцию деловой древесины, если ее сажать вместе с ценными породами деревьев. Биологическая фиксация азота идет в автотрофном и гетеротрофном ярусах экосистем, в аэробных и анаэробных зонах.
Но большинство наземных растений и высших водорослей, несмотря на огромное количество азота в атмосфере, способны усваивать его лишь в виде ионов, т. е. в виде NH4+, NО2 или NО3.
Итак, только примитивные микроорганизмы могут превращать биологически бесполезный газообразный азот в формы, усвояемые растениями. Они образуют взаимовыгодные ассоциации с высшими растениями, усиливающие фиксацию азота. Растения предоставляют бактериям «квартиры» (корневые клубеньки), защищают от избытка кислорода и поставляют необходимую энергию (органические вещества). За это растения получают азот в доступной для них форме. Для расщепления N2 бактериям необходимо много энергии на разрыв тройной связи (N=N). Бактерии в клубеньках бобовых расходуют на фиксацию 1 г атмосферного азота около 10 г глюкозы (примерно 40 ккал), синтезируемой растением на свету. При промышленной фиксации N2 (получение NH3) также расходуется много энергии горючих ископаемых, поэтому азотные удобрения стоят дороже любых других. Таким образом, центральное место в биотической циркуляции азота занимает NH3.
Влияние человека на круговорот азота достаточно велико.
Он выращивает на обширных площадях бобовые растения, а также промышленным способом связывает азот.
Подсчитано, что сельское хозяйство и промышленность дают почти на 60 % больше фиксированного азота, чем естественные наземные экосистемы. В этом случае люди пытаются копировать природную стратегию взаимовыгодного сотрудничества, способствующую выживанию. Если бы специалистам по генной инженерии удалось индуцировать образование клубеньков у пшеницы, кукурузы, риса и других пищевых культур, это помогло бы сэкономить немало средств и энергии, избавило бы от необходимости внесения азотных удобрений. Хороших результатов можно достигнуть и сейчас, если лучше использовать бобовые в сельском хозяйстве. Бобовые растения - природные фиксаторы азота - работают активнее в среде с малым количеством азота, поэтому внесение азотных удобрений под бобовые не имеет смысла, так как выключает биофиксацию атмосферного М2. Из азота, поступившего с удобрениями, очень небольшая часть вовлекается в круговорот повторно. Большая доля его теряется: выносится с водой, с урожаем и в процессе денитрификации. В США, например, количество используемых азотных удобрений с 1950 г. возросло в 12 раз, а урожай - не более чем в 2 раза. Кроме того, избыток нитратов в пище и воде может быть опасен для людей. Напрасной траты азота и энергии можно избежать, если рационально чередовать зерновые и бобовые культуры в севообороте.
Ежегодно в глобальном круговороте биотическим сообществом усваивается около 109 т азота. При этом 80 % его поступает с суши и воды и лишь около 20 % добавляется «нового» азота из атмосферы.
В масштабе биосферы, благодаря механизмам обратной связи и большому резервному фонду, круговорот азота относительно совершенен. Хотя часть азота из густонаселенных областей уходит в глубоководные океанические отложения и выключается из круговорота, возможно, на «миллионы лет - эта потеря в какой-то мере компенсируется поступлением его в воздух с вулканическими газами. Следовательно, извержения вулканов нельзя считать только вредными. Если бы вдруг удалось заблокировать все вулканы на Земле, то можно предположить, что от голода страдало бы не меньше людей, чем сейчас страдает от их извержений.
Антропогенная денитрификация (удаление избыточных нитритов и нитратов) и стремление к сокращению производства нитратных удобрений соответствуют природным процессам и способствуют сохранению цикличности движения азота.
В последнее время содержание N2 в атмосфере не менялось. Можно думать, что поступление его в атмосферу (денитрификация) и отток из атмосферы (азотфиксация) в целом уравновешены, хотя, возможно, фиксация слегка преобладает вследствие деятельности человека.
Осадочные циклы
Для большинства химических элементов и соединений, которые обычно связаны с лито- и гидросферой, а не с атмосферой, характерны осадочные циклы. Циркуляция таких элементов осуществляется путем эрозии, осадкообразования, горообразования, вулканической деятельности и переноса веществ организмами. Твердые вещества, переносимые по воздуху как пыль, выпадают на землю в виде сухих осадков или с дождем. Осадочные циклы имеют общую направленность «вниз». Примечательно, что Азия - часть света с древнейшими цивилизациями. В течение длительной истории ее территория испытывала антропогенный пресс, который и привел к наибольшим потерям почвенного материала.
Живым сообществам биосферы доступны в основном те химические элементы, которые входят в состав пород, расположенных на поверхности Земли. Одним из важных для биосферы элементов, недостаток которого на поверхности ограничивает рост растений, является фосфор. Циркуляция его легко нарушается, так как основная масса вещества сосредоточена в малоактивном и малоподвижном резервном фонде, захороненном в земной коре. Если «захоронение» совершается быстрее, чем обратный подъем на поверхность, то значительная часть обменного материала на длительное время выбывает из круговорота. Такая ситуация складывается часто, когда добывают фосфатные породы: свалки отходов производства возникают вблизи шахт и заводов, а часть фосфора выключается из оборота.
Человек так изменяет движение многих веществ, что круговороты становятся несовершенными, теряют цикличность. В результате в одних местах возникает недостаток, а в других - избыток некоторых веществ. Механизмы, обеспечивающие возвращение веществ в круговорот, основаны главным образом на биологических процессах.
Наибольшее значение имеет в биосфере круговорот фосфора.
Круговорот фосфора. Фосфор - один из наиболее важных биогенных элементов. Он входит в состав нуклеиновых кислот, клеточных мембран, ферментов, костной ткани, дентина. По сравнению с азотом он встречается в относительно немногих химических формах. В биотический круговорот фосфор поступает в процессе разрушения протоплазмы организмов и постепенно переходит в фосфаты.
Особенность биогеохимического цикла фосфора заключается в том, что, в отличие от азота и углекислого газа, резервным фондом его является не атмосфера, а горные породы и отложения, образовавшиеся в прошлые геологические эпохи.
Поступление фосфора в круговорот происходит в основном:
1) в процессе эрозии фосфатных пород (в том числе, гуано) и
2) вследствие минерализации продуктов жизнедеятельности и органических остатков растений и животных.
Образующиеся фосфаты (РО43-) поступают в наземные и водные экосистемы, где вновь могут потребляться растениями.
Потребляется фосфор растениями и животными для построения белков протоплазмы и в промышленном производстве удобрений и моющих средств (рис. 4.5).
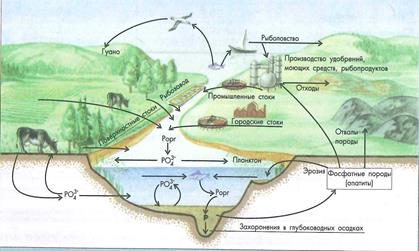
Рисунок 4.5- Биотический круговорот фосфора
Механизмы возвращения фосфора в круговорот в природе недостаточно эффективны и не возмещают его потерь. Сейчас не происходят сколько-нибудь значительные поднятия отложений на поверхность. Вынос фосфатов на сушу осуществляется в основном с рыбой. Но это не компенсирует их поток с суши в море. Морские птицы также участвуют в возвращении фосфора в круговорот (например, скопления гуано на побережье Перу). Однако перенос фосфора и других веществ из моря на сушу птицами сейчас происходит не столь интенсивно, как в прошлом.
Влияние деятельности человека на циркуляцию фосфора ведет к потерям фосфора и захоронению его на дне океана, что делает цикл менее замкнутым. Так, по некоторым оценкам, с морской рыбой, вылавливаемой человеком, на сушу возвращается лишь около 60 тыс. т в год элементарного фосфора. Добывается же ежегодно около 2 млн т фосфорсодержащих пород. Большая часть этого фосфора попадает в море с моющими средствами, в производстве которых он используется, и с удобрениями, т. е. выключается из круговорота. Так, например, потери фосфора с ненарушенных облесенных водосборных бассейнов невелики и компенсируются поступлениями с дождем и продуктами выветривания. Но ниже по течению рек, где деятельность человека активна, - иная картина. С увеличением степени освоения, т. е. с увеличением площадей, занятых сельскохозяйственными полями и городами, в водах рек резко возрастает содержание фосфора. В воде, стекающей с городских территорий, в 7 раз больше этого элемента, чем в воде реки, протекающей по местности, занятой лесом.
Кроме того, в стоке с освоенных территорий до 80 % фосфора содержится в минеральной форме, т. е. в виде фосфатов, а в стоке с территорий, занятых естественной растительностью, преобладают органические соединения фосфора. Однако смыв фосфорных удобрений с полей не столь велик, как азотных, так как в воде фосфаты малорастворимы, а в щелочной среде - практически нерастворимы, и поэтому задерживаются почвенными частичками. А усвоение их растениями сильно зависит от кислотности почвенного раствора и растворимости образующихся соединений.
Исследования показали, что в наземных экосистемах большая часть фосфора находится в связанной форме и недоступна для растений. Отсюда можно сделать очень важный для практики вывод: избыток удобрений может оказаться столь же невыгодным, как и их недостаток. Если в почву вносится больше вещества, чем могут использовать в данный момент организмы, избыток его быстро связывается почвой и отложениями, становясь недоступным именно в тот период, когда он наиболее необходим организмам. Многие полагают, что если на площадь их сада следует внести 1 кг удобрений, то 2 кг принесут в два раза больше пользы. Но субсидии превращаются в источник стресса, если применять их в избытке.
Основные потери фосфора из круговорота происходят при сбросе промышленных, городских и сельскохозяйственных сточных вод в водоемы; при применении избыточных количеств фосфорных удобрений и фосфорсодержащих моющих средств Правда, производство последних в некоторых странах уже запрещено. При этом серьезные опасения вызывает также «цветение» воды вследствие «удобрения» ее избыточным количеством фосфатов. Следствием этих процессов, из-за массового развития и отмирания водорослей, является вторичное загрязнение воды и захоронение фосфора с остатками водорослей.
В конечном счете, если мы хотим предотвратить угрозу голода, придется серьезно заниматься возвращением фосфора в круговорот. Уповать на геологические подъемы отложений в некоторых районах Земли, которые вернут на сушу «потерянные фосфаты», вряд ли возможно. Разумнее искать другие пути предотвращения потерь фосфора и прежде всего сократить его сброс в водные объекты. Следует активнее использовать сточные воды для орошения наземной растительности, которая аккумулирует фосфор на поверхности, или пропускать их через естественные водно-болотистые угодья, вместо того чтобы сбрасывать в реки.
Сохранение цикличности круговорота фосфора очень важно, потому что из всех биогенных веществ, необходимых организмам в больших количествах, фосфор - один из наименее доступных элементов на поверхности Земли. Фосфор и теперь часто лимитирует первичную продукцию экосистем, а в будущем его лимитирующее значение может резко возрасти, что грозит снижением пищевых ресурсов планеты.
Дата добавления: 2018-11-25; просмотров: 2402;
