Свинцовый аккумулятор
Pb │H2SO4 │PbO2│ Pb
25 – 30 %
Анодный процесс:
Pb – 2e  Pb
Pb 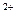
Образующиеся ионы Pb 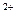 осаждаются на поверхности анода в виде малорастворимого PbSO4
осаждаются на поверхности анода в виде малорастворимого PbSO4
Катодный процесс:
PbO2 + 4H3O 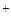 + 2e
+ 2e  Pb
Pb 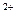 + 6H2O
+ 6H2O
Образующиеся ионы Pb 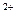 осаждаются на поверхности катода в виде
осаждаются на поверхности катода в виде
PbSO4
Тогда суммарная токообразующая реакция:
Pb + PbO2 + 2H2SO4  2 PbSO4 + 2H2O ЭДС = 2,1 В.
2 PbSO4 + 2H2O ЭДС = 2,1 В.
Сущность – более энергетически богатые Pb и PbO2 переходят в менее энергетически богатое вещество PbSO4.
Во внутренней цепи происходит перенос ионов. Ионы SO4 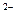 движутся к аноду, а ионы H
движутся к аноду, а ионы H 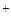 - катоду. У анода расходуются анионы, у катода – катионы. Раствор в целом остаётся электронейтральным.
- катоду. У анода расходуются анионы, у катода – катионы. Раствор в целом остаётся электронейтральным.
ЭДС зависит от конц. H2SO4 и для 25% конц. ~ 2 В. Так как H2SO4 при работе связывается, поэтому ЭДС уменьшается. По концентрации кислоты можно судить о степени разряда аккумулятора. На практике измеряется не сама концентрация., а плотность раствора H2SO4.
Недостаток – сравнительно небольшой.
1. Срок службы (из-за постоянной сульфатации электродов – неполное превращение PbSO4 в Pb и PbO2 при заряде)
(2 – 5 лет)
2. Малая удельная ёмкость/на единицу массы (кол-во электричества, которое отдаётся на единицу массы вещества).
3. Особенность электрохимических генераторов состоит в том, что электрохимически активные вещества не закладываются заранее, а подводятся по мере израсходования. Это обеспечивает непрерывность работы.
Свинцовой аккумулятор не должен сильно разряжаться. Если ЭДС падает до 1,8 , то модно считать, что он полностью истощен. В его работе происходит испарение воды и частичное ее разложение, поэтому необходимо добавлять воду в дистиллированную. Всякие примеси снижают КПД. Для зарядки аккумулятора подключают к внешнему источнику тока. При этом ток протекает через аккумулятор в направлении обратном тому, в котором он проходил при зарядке аккумулятора. И электрохимические процессы на электродах обращаются.
Щелочной аккумулятор:
Значительное распространение имеют щелочные железо- или кадмий-никелевые аккумуляторы.
Fe │КОН │NiOOH │Ni ЭДС = 1,35 - 1,4 А
20%
Fe + 2NiOOH + H2O  2 Ni(OH) + Fe(OH)2
2 Ni(OH) + Fe(OH)2
Анодом служит Fe (или кадмиевая) пластина. Катод – никель.
Железо – никелевый аккумулятор.
Электролит 20% КОН.
ЭДС = 1,3 В
Обычно они выпускаются в продажу в виде батарей, состоящих из нескольких ячеек, включенных последовательно. В отличии от кислотных, щелочные аккумуляторы могут долго находиться в заряженном и разряженном состоянии. Щелочные дороже Pb аккумуляторов, но они не чувствительны к большим перегрузкам.
Дата добавления: 2018-11-25; просмотров: 355;
