Каким образом получается неправдоподобно высокий КПД?
Отопительная система с конденсационным котлом благодаря особой конструкции поверхностей нагрева теплообменника отбирает у продуктов сгорания не только явное тепло, но и теплоту конденсации водяного пара и передает это суммарное тепло в отопительную систему. Используя принятые термины, можно сказать, что в конденсационном котле располагаемым теплом является не низшая теплота сгорания топлива, которая упоминалась в предыдущих разделах и выпусках, а высшая теплота сгорания, которая включает также теплоту конденсации, или «скрытую теплоту парообразования», водяного пара, образующегося при сгорании углеводородного топлива. Обе эти величины относятся к количеству тепла, высвобождающемуся при сгорании. При этом высшая теплота сгорания дополнительно включает теплоту конденсации, которая в случае обычных котлов безвозвратно покидает отопительную установку через дымовую трубу.
Количественная оценка разности между высшей и низшей теплотой сгорания зависит от вида топлива. Для природного газа она составляет около 11%. Это приводит к тому, коэффициент полезного действия, который принято определять по низшей теплоте сгорания, при полной конденсации может теоретически доходить до 111%. В высокоэффективном теплообменнике конденсационного котла уходящие газы охлаждаются почти до температуры воды в обратной линии. При этом КПД приближается к 110% и, стало быть, практически достигает физической границы.
Степень использования теплоты конденсации зависит, в первую очередь, от температурного режима системы отопления. Чем ниже температура воды на входе в конденсационный аппарат, тем глубже могут быть охлаждены дымовые газы и тем более полно может быть использован эффект конденсации. Этому вопросу придается большое значение при использовании конденсационного котла в составе отопительных установок как новых, так и модернизируемых. Целью проектирования такой установки должно быть обеспечение как можно более полной конденсации при любой температуре воды в обратной линии отопительной системы. Естественно, при реализации этой задачи следует уделять внимание и температуре точки росы. Чем выше температура точки росы, тем лучше возможности использования теплоты конденсации
Объем газов Vизмеряют в кубических метрах (м3). Вследствие того, что объем газов изменяется при нагревании, охлаждении и сжатии, за его единицу принимают 1 м3 газа при нормальных условиях. Если температура t или давление Р отличаются от нормальных, то объем газа при нормальных условиях V0определяется по формуле
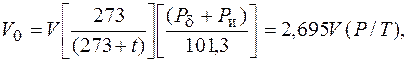
где V – объем газа, измеренный при рабочих условиях, м3;
Рd – барометрическое давление, кПа, нормальное атмосферное давление Рd = 101,3 кПа;
Ри – избыточное давление (измеренное манометром), кПа; Р – абсолютное давление, кПа,
Р = Рd + Ри;
t – температура, °С.
Известно, что плотность газов и их объем зависят от температуры. С повышением температуры объем газа в незамкнутых пространствах увеличивается, а в замкнутых возрастает его избыточное давление. В обоих случаях изменяется плотность газа. Для возможности сравнения свойств различных газов основные их характеристики должны быть приведены к одинаковым условиям. В технических расчетах это нормальные условия (Р = 760 мм рт. ст. t = 0 °С).
В финансовых же расчетах между поставщиками и потребителями газа применяют стандартные условия. В этом случае фактический объем газа, измеренный приборами учета при рабочем давлении и температуре, приводят с помощью специальных таблиц к объему при давлении 760 мм рт. ст. и температуре 20 °С. Плотность газа при нормальных условиях обозначается r0.
Зависимость изменения плотности при изменениях температуры и давления может быть выражена для газа однокомпонентного состава формулой
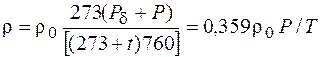 ,
,
где r – плотность газа при температуре отличной от 0 °С; r0 – плотность газа при температуре 0 °С и давлении 760 мм рт.ст.; Р – фактическое избыточное давление, мм рт. ст.; Рd – атмосферное (барометрическое) давление, мм рт. ст.; t – температура газа, °С; Р – абсолютное давление, мм рт. ст.; Т – абсолютная температура, К;
Плотность сложных газов при нормальных физических условиях может быть определена по формуле
rсм = 0,01(Sri × ri),
rсм = 0,01(r1r1 + r2r2 + ... + rnrn) = 0,01(0,72×СН4 + 1,35×С2Н6 +
+ 2,01×С3Н8 + 2,7×С4Н10 + 3,22×С5Н12 + 1,53×Н2S + 1,97×СО2 +
+ 1,25×N2) кг/м3;
ρ1, ρ 2, ..., ρn – плотность компонентов газа, кг/м3;
r1, r2, ..., rn – содержание компонентов, %.
1 бар = 100 кПа, 1 кПа = 10 мбар
Число Воббе Wo – показатель, также характеризующий тепловые свойства газа во взаимосвязи с его относительной плотностью. Определяется по формуле:
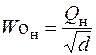 или
или 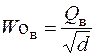
где Woн и Woв – число Воббе низшее и высшее, кДж/м3; Qн – низшая теплота сгорания газа, кДж/м3; Qв – высшая теплота сгорания газа, кДж/м3; d – относительная плотность газа.
Определение относительной плотности
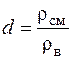
где rсм – плотность смеси сложного газа при нормальных физических условиях, кг/м3; rв =1,29, кг/м3 – плотность воздуха при нормальных физических условиях.
Равенство чисел Воббе 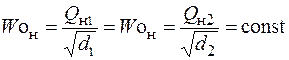
указывает на взаимозаменяемость газов, т. е. возможность их использования в одном горелочном устройстве без изменений конструкции последнего. Практически считается, что взаимозаменяемость газов без нарушения нормальной работы газогорелочных устройств возможна при колебаниях числа Воббе в пределах ±5% номинального значения и равенстве скоростей распространения пламени. ПГ и СУГ имеют скорость распространения пламени 0,36–0,37 м/сек. Скорости распространения пламени ИГ и БГ значительно отличаются от скорости сгорания ПГ и СУГ из-за присутствия в них значительного количества балластных газов и водорода.
С целью обеспечения полноты сгорания газа количество воздуха, поступающего в горелку должно быть не менее определенного значения, зависящего от вида газа, его теплоты сгорания. Теоретический расход воздуха приблизительно может быть определен по имперической формуле:
Vт = Qн/ 3,77 м3 для сжигания 1 м3 газа
Vт – теоретический расход воздуха, необходимый для полного сгорания газа
Qн – низшая теплота сгорания газа в МДж/м3.
Например, для сжигания природного газа с Qн= 35,88 МДж/м3 потребуется 9,52 м3 воздуха, а для сжиженного углеводородного с Qн= 93,18 МДж/м3 газа потребуется 24,7 м3 воздуха.
Горение метана:
СН4 + 2 О2 + 7,52N2 = СО2+2Н2О+ 7,52 N2
При недостатке воздуха (или кислорода в воздухе) при горении газа образуются продукты не полного сгорания, в их состав входят токсичные и вредные вещества:
СН4 + О2 + 7,52N2 = 0,5СО2 + 0,5СО+Н2О + СН2О+ 7,52 N2
СН4 + 0,5 О2 + 7,52N2 = СО+ОН + СН2О+Н2+С20Н12+С+ 7,52 N2
СН2О – формальдегид ПДК 0,035 мг/м3, общетоксическое действие. 40% - раствор формальдегида в воде – формалин.
С20Н12 –бенз(а)пирен ПДК 0,1 мкг/100м3 .
СО – угарный газ, он не имеет запаха и цвета, поэтому обнаружить его присутствие в помещении не возможно без газоанализаторов. При концентрации СО в воздухе помещения:
0,2 мг/л (0,16%) - появляется головная боль, пульсация в висках;
0,5 мг/л (0,4%) - учащение дыхания, пульса, судороги;
1, 25 мг/л (1%) -слабый пульс, остановка дыхания, смерть.
ПДК в атмосферном воздухе – 3 мг/м3 = 0,003 мг/л
ПДК в жилых помещениях -2 мг/м3 = 0,002 мг/л
ПДК в производственных помещениях -20 мг/м3 = 0,02 мг/л.
Пределы воспламеняемости. Диапазон необходимой концентрации газа в смеси с воздухом, при котором возможна реакция окисления (горения), начинающаяся с внесением открытого огня или другого источника высокой температуры, называют пределами воспламеняемости или пределами взрываемости. Минимальное процентное (по объему) содержание горючего газа в смеси с воздухом, при котором с введением источника огня начинается реакция горения горючих компонентов газа, называют нижним пределом воспламеняемости (взрываемости) Lн, а максимальное – верхним пределом воспламеняемости (взрываемости) Lв в % объемных. Значения пределов воспламеняемости отдельных горючих газов приведено в табл. 4. При содержании газа в газовоздушной смеси меньше нижнего предела воспламеняемости горения не будет. Если газа в газовоздушной смеси больше верхнего предела воспламеняемости, эта смесь может гореть, взрыва не будет. Воздуха в этой смеси не достаточно для сгорания газа, присутствующего в смеси, поэтому сгорит столько газа на сколько хватит воздуха.
Пределы воспламеняемости (взрываемости) сложных газов можно определить по формуле Ле Шателье:
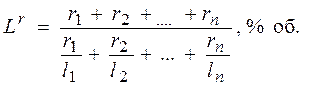
где 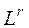 – нижний или верхний предел воспламенения сложного газа в газовоздушной или газокислородной смеси, % об.;
– нижний или верхний предел воспламенения сложного газа в газовоздушной или газокислородной смеси, % об.; 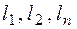 – нижние или верхние пределы воспламения отдельных компонентов сложного газа в газовоздушно смеси в % об. по данным табл. 2;
– нижние или верхние пределы воспламения отдельных компонентов сложного газа в газовоздушно смеси в % об. по данным табл. 2; 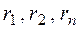 –содержание отдельных компонентов в сложном газе, % об.;
–содержание отдельных компонентов в сложном газе, % об.; 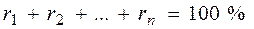 ;
;
При наличии в газе небольшого количества балластных примесей пределы воспламеняемости могут быть определены по формуле:
Нижний предел воспламеняемости с балластом:
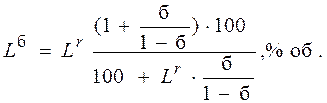
где 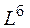 – нижний или верхний предел воспламенения смеси, содержащей инертные (балластные) примеси, % об.;
– нижний или верхний предел воспламенения смеси, содержащей инертные (балластные) примеси, % об.; 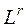 – нижний или верхний предел воспламенения горючей части смеси, % об.;
– нижний или верхний предел воспламенения горючей части смеси, % об.; 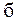 – содержание балластных примесей (СО2 и N2), в долях единицы.
– содержание балластных примесей (СО2 и N2), в долях единицы.
При содержании в газе балластных примесей для определения пределов воспламеняемости необходимо пересчитать процентное содержание горючей части. Например, в смеси присутствует 90 процентов горючих газов и 10 процентов не горючих, т. е. балласта. Принимаем 90% за 100% и определяем для каждого горючего компонента смеси его новое процентное количество. Определение нового процентного содержания горючих компонентов выполняют следующим расчетом:
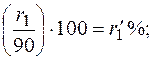
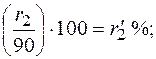
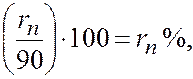
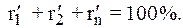
Опасные свойства горючих газов. Обладая высокими теплотой сгорания, температурой горения и незначительной температурой воспламенения, все углеводородные газы чрезвычайно опасны при разгерметизации газопроводов, газового оборудования и газовых резервуаров. При даже незначительных, на первый взгляд, утечках газа в плохо вентилируемых помещениях могут создаваться взрыво- и пожароопасные газовоздушные смеси.
Для определения утечек газу придают запах путем добавки остропахнущего вещества – этилмеркаптана C2H5SH. Такой процесс называется одоризацией газов. Запах одорированного газа должен ощущаться при содержании его в воздухе около 1/5 нижнего предела воспламенения.
Дата добавления: 2018-06-28; просмотров: 896;
