Химические системы аккумулирования энергии
Химические системы аккумулирования энергии предполагают ее накопление в форме энергии связи электронов с ядрами в атомах или связи атомов в молекулах. Пример механизма химического аккумулирования энергии - реакция, протекающая у электродов электрических батарей - электрохимических аккумуляторов.
Электрическая батарея – комбинация включенных параллельно или последовательно двух и более электрохимических элементов. Она заряжается путем питания от внешнего источника электрической энергией, которая в электрохимических элементах преобразуется в химическую энергию, а при подключении на внешнюю нагрузку (потребителя) снова выдает электрическую энергию. Таким образом, электрохимический аккумулятор работает в режиме «заряд-разряд».
Наиболее распространенным на сегодняшний день типом аккумуляторов является свинцово-кислотный аккумулятор, принципиальная схема электрохимического элемента которого представлена на Рис. 31.

Рис.31.Принципиальная схема электрохимического элемента
В электролит – слабо концентрированную серную кислоту 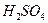 погружены анод из пористого свинца Рb, служащий топливом и отдающий электроны, и катод – набор сеток, заполненных перекисью свинца
погружены анод из пористого свинца Рb, служащий топливом и отдающий электроны, и катод – набор сеток, заполненных перекисью свинца 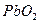 , на котором происходит восстановление (поглощение) электронов с веществом-окислителем. Реакции, протекающие в электрохимическом элементе в режиме разряда при подключении на внешнюю нагрузку, имеют вид:
, на котором происходит восстановление (поглощение) электронов с веществом-окислителем. Реакции, протекающие в электрохимическом элементе в режиме разряда при подключении на внешнюю нагрузку, имеют вид:
на аноде – 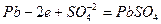 ,
,
на катоде – 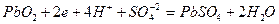 .
.
Аккумулятор работает до тех пор, пока оба электрода не покроются сульфатом свинца 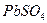 , а его восстановление осуществляется зарядкой путем подключения к внешнему источнику напряжения [58].
, а его восстановление осуществляется зарядкой путем подключения к внешнему источнику напряжения [58].
Дата добавления: 2017-12-07; просмотров: 1505;
