Диффузионная область гетерогенных процессов
В результате протекания гетерогенной химической реакции в разных точках реакционного пространства устанавливаются различные концентрации реагирующих веществ и продуктов реакции. Например, при взаимодействии газообразного реагента А с твердым реагентом В концентрация вещества А у поверхности реагента В будет в общем случае меньше, чем в ядре газового потока, обтекающего твердую частицу.
Градиент (разница) концентраций реагента А является причиной возникновения диффузии - самопроизвольного процесса переноса вещества в результате беспорядочного движения молекул до установления равновесного распределения концентраций. Хаотичное тепловое движение частиц вещества вызывает упорядоченный направленный перенос его в области, в которой возникают градиенты концентрации или в которой распределение концентраций отличается от равновесного.
При рассмотрении гетерогенных процессов важно знать, какова скорость диффузии на стадиях, предшествующих химической реакции, не будут ли диффузионные процессы тормозить химическое взаимодействие.
Скорость диффузии зависит от плотности и вязкости среды, температуры, природы диффундирующих частиц, воздействия внешних сил и т.д. Закономерности диффузионных процессов описываются законами Фика.
Согласно первому закону Фика количество вещества А, перенесенного путем диффузии в единицу времени через поверхность, перпендикулярную направлению переноса, пропорционально градиенту концентрации этого вещества в данный момент времени.
В общем случае концентрация меняется как в пространстве, так и во времени. Изменение концентрации вещества А во времени в результате молекулярной диффузии описывается вторым законом Фика
При протекании гетерогенного процесса у поверхности раздела фаз расходуются исходные реагенты и образуются продукты реакции. Для стационарного протекания процесса необходимо непрерывное пополнение убыли реагентов у реакционной поверхности и удаление от нее образующихся продуктов. Перенос осуществляется путем диффузии при наличии перепада концентраций. Чем быстрее идет реакция, тем выше должна быть скорость диффузии, иначе химическая реакция будет тормозиться диффузионными процессами.
Можно считать, что перепад концентраций возникает в так называемом диффузионном подслое, находящемся у поверхности раздела фаз. Внутри этого подслоя перенос вещества осуществляется исключительно молекулярной диффузией. Чем меньше толщина подслоя 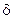 (м), тем больше коэффициент массоотдачи
(м), тем больше коэффициент массоотдачи 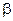 (м/с)
(м/с)
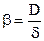
Коэффициент молекулярной диффузии Dявляется функцией молекулярных свойств того вещества, которое диффундирует, и того вещества, в котором происходит диффузия первого. Этот коэффициент слабо возрастает с ростом температуры и уменьшается с ростом давления. Чаще всего коэффициент Dопределяют опытным путем, а также расчетом по эмпирическим или полуэмпирическим зависимостям.
Дата добавления: 2017-11-04; просмотров: 2128;
