Современные представления о строении атома
Представление о мельчайших неделимых частицах материи – «кирпичиках» мироздания возникло в глубокой древности. Впервые понятие об атоме как последней и неделимой частице тела («атомос» - неделимый, неразложимый) сформулировано в античной Греции в рамках натурфилософского учения. Идея атомизма оказалась весьма продуктивной для объяснения эмпирических законов для процессов в идеальных газах, теплового расширения тел и различных химических законов. Однако к началу XX в. выяснилось, что атом не является неделимым, были экспериментально обнаружены частицы его составляющие – электрон (Дж. Томсон, 1897), протон (Э. Резерфорд, 1919), нейтрон (Д. Чедвик, 1932).
Одной из первых попыток создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно модели Томсона атом представляет собой равномерно заряженный положительный шар радиусом порядка 10-10 м, внутри которого около положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара. Модель атома Томсона оказалась несостоятельной и сейчас представляет только исторический интерес.
Большую роль в развитии представлений о строении атома сыграли опыты Э.Резерфорда по рассеянию α-частиц в веществе. Резерфорд предложил ядерную (планетарную) модель атома (1911). Согласно этой модели, вокруг положительно заряженного ядра с зарядом Ze (Z – порядковый номер химического элемента в системе Менделеева, e – элементарный заряд) по замкнутым орбитам движутся Z электронов. Вся масса атома практически сосредоточена в ядре, линейные размеры которого составляют величину порядка 10-15 м. Линейные размеры электронной оболочки атома по порядку величины равны 10-10 м. Заряд ядра равен суммарному заряду электронов; атомы нейтральны.
Модель атома Резерфорда основана на классической электродинамике, согласно которой электрический заряд, движущийся по криволинейной траектории (с ускорением) должен излучать электромагнитные волны и непрерывно терять энергию. Поэтому такая система будет неустойчивой, что противоречит действительности.
Таким образом, построить модель атома в рамках классической физики оказалось невозможным. Попытка построения качественно новой – квантовой – теории атома была предпринята Н. Бором (1913). Бор сформулировал знаменитые постулаты, с помощью которых сумел во многом объяснить закономерности в линейчатых спектрах атома водорода и водородоподобных систем. Однако, будучи внутренне противоречивой (применяя как законы классической физики, так и квантовые постулаты) теория Бора не смогла описать атом гелия – один из простейших атомов, следующий в Периодической системе химических элементов непосредственно за атомом водорода.
Последовательная теория атомных явлений появилась только после создания квантовой механики, описывающей законы движения и взаимодействия микрочастиц с учетом их волновых свойств.
По современным представлениям атом состоит из положительно заряженного ядра, состоящего из протонов и нейтронов, и отрицательно заряженных электронов. Электроны располагаются вокруг ядра в виде электронного облака. Заряд ядра равен суммарному заряду электронов, поэтому атом электрически нейтрален.
Для описания атома в квантовой механике решается уравнение Шредингера, позволяющее найти соответствующие собственные волновые функции и собственные значения энергии. Согласно этому решению, энергия электронов, их орбитальный момент импульса, проекция момента импульса на выделенное направление в пространстве дискретны или квантованы.
Опытные данные свидетельствуют о том, что электрон (и ряд других элементарных частиц) обладают собственным механическим моментом импульса (спином), не связанным с их движением в пространстве. Проекцию момента импульса электрона на выделенное направление в пространстве также оказывается квантованной.
Состояние электрона в атоме описывается набором четырех квантовых чисел: n, l, m и s.
n называется главным квантовым числом и характеризует энергию электрона в атоме.
Орбитальное число l характеризует момент импульса электрона в атоме.
Магнитное число m определяет проекцию момента импульса на выделенное направление в пространстве (например, на направление магнитного поля).
Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m характеризует ориентацию электронного облака в пространстве. На рисунке 14 представлены формы и ориентации электронных облаков различных электронов. Электроны, для которых орбитальное число l=0, называются s-электронами. Для этих электронов электронное облако имеет форму шара. Электронное облако p-электронов (l=1) имеет форму гантели и три возможных ориентации в выбранной системе координат. Электроны, для которых орбитальное число l=2, называются d-электронами; электронное облако d-электронов имеет 5 возможных ориентаций в выбранной системе координат.
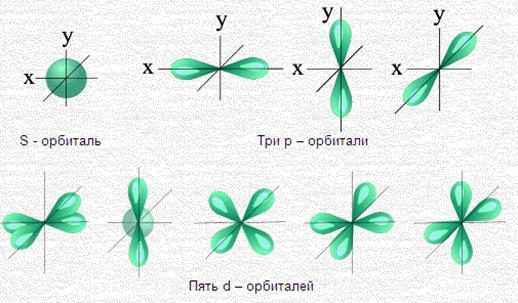
Рисунок 14 – Формы и ориентация в пространстве
различных электронных облаков (орбиталей)
Спиновое число sхарактеризует проекцию момента импульса электрона на выделенное направление в пространстве.
Большое значение в квантовой механике имеет принцип Паули. Применительно к атому этот принцип утверждает, что в атоме не может быть двух электронов, обладающих одинаковым набором всех четырех квантовых чисел. Принцип Паули лежит в основе систематики заполнения электронных состояний в атомах и позволяет объяснить Периодическую систему элементов Д.И. Менделеева.
Исследования спектров излучения разреженных газов (т.е. отдельных атомов) показали, каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий и групп близко расположенных линий. На рисунке 15 представлены энергетический спектр и спектральные серии излучения атома водорода. Квантовая механика позволила описать излучение (и поглощение) энергии атомом и, соответственно, объяснить линейчатый спектр. При переходе с одного энергетического уровня (Em) на другой (En) атом испускает или поглощает квант энергии электромагнитного поля (фотон)
hn=Em - En. (5.1)
В зависимости от величины кванта энергии спектральная линия попадает в ультрафиолетовую (УФ), инфракрасную (ИК) области или в область видимого излучения.
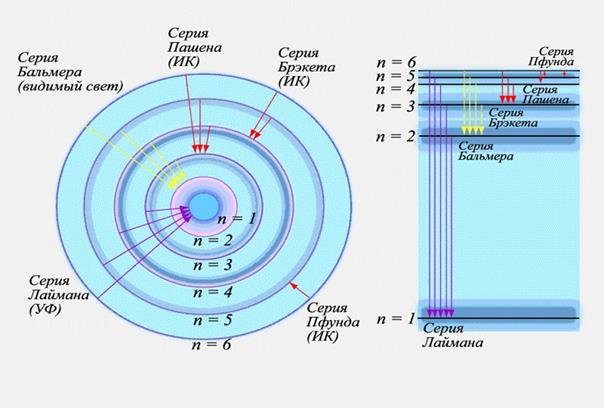
Рисунок 15 – Энергетические уровни атома водорода
Дата добавления: 2017-10-09; просмотров: 1830;
