Влияние ионного состава электролита и рН электролита на коррозию металла.
Интенсивность процесса коррозии металла зависит от природы электролита и концентрации растворенных в нем веществ. С увеличением электропроводности и концентрации электролита ускоряется процесс коррозии. Катионы активных металлов (Мn 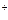 , К
, К 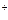 , Са2+, Мg2+ и другие) существенного влияния на коррозию металлов не оказывают. Катионы неактивных металлов Аg
, Са2+, Мg2+ и другие) существенного влияния на коррозию металлов не оказывают. Катионы неактивных металлов Аg 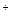 , Аu
, Аu 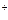 , Сu2+являющиеся окислителями, не редко усиливают коррозию Fе и А1.
, Сu2+являющиеся окислителями, не редко усиливают коррозию Fе и А1.
Особенно активными стимуляторами коррозии являются:
1) анионы галогенов F 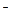 , Сl
, Сl 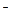 , Вr
, Вr 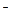 они разрушают защитные пленки металлов и делают последние термодинамически неустойчивыми:
они разрушают защитные пленки металлов и делают последние термодинамически неустойчивыми:
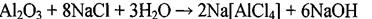
2) Часть ионов (Сr2О7 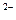 , SО4
, SО4 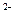 ) способствует образованию на поверхности металлов защитных окисных пленок, которые замедляют процесс коррозии. В этом случае поверхность металла становится пассивной.
) способствует образованию на поверхности металлов защитных окисных пленок, которые замедляют процесс коррозии. В этом случае поверхность металла становится пассивной.
3)Комплексообразователи (NН3, CN и т.д.) связывают ионы металла в слабодиссоциирующие комплексы.
NН 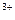 сильно ускоряют коррозию медных сплавов:
сильно ускоряют коррозию медных сплавов:
Cu2++4NH3→[Cu(NH3)4]2+
Влияние рН среды:
Кислотность среды неодинаково влияет на процесс коррозии (рис.3 и рис.4)

Рис.3: влияние рН на коррозию Zn, А1, Sn, Рb , V в нейтральной среде.
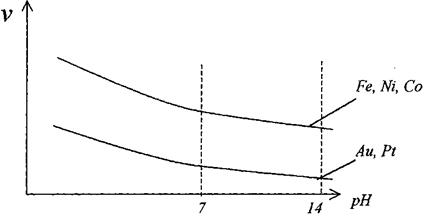
Рис.4: зависимость V коррозии Fе, Со, Ni, Рt, Аu:
Данные металлы наиболее устойчивы в щелочной среде.
Дата добавления: 2017-09-19; просмотров: 511;
