Консервирование тканей и органов
Для трансплантации пригодны ткани и органы людей, погибших в результате несчастных случаев (травм) или скоропостижно скончавшихся от различных причин (например, инфаркт миокарда, апоплексия мозга). Противопоказаниями для изъятия и консервирования тканей и органов считают такие причины смерти, как отравления, СПИД, злокачественные опухоли, малярия, туберкулёз, сифилис и т.п. Целесообразно у потенциального донора брать внутренние органы сразу же после констатации смерти мозга. Ткани (кожу, сухожилия, роговицу и др.) изымают и консервируют в первые 6 ч после смерти.
Изъятие тканей и органов для трансплантации производят в специальных помещениях с соблюдением правил асептики и антисептики. Взятые ткани и органы тщательно отмывают от крови и тканевой жидкости и затем консервируют, используя для этого различные методы.
• Помещение в растворы, содержащие антисептические средства или антибиотики, с последующим хранением в охлаждённых растворах, плазме или крови реципиента.
• Быстрое замораживание при температуре от -183 °С до -273 °С с последующим хранением при температуре от -25 °С до -30 °С.
• Лиофилизацию (замораживание с последующей сушкой в вакууме) применяют для консервирования костей.
• Погружение в парафин, растворы альдегидов (формальдегида, глутаральдегида). В специальных контейнерах ткани и органы из лаборатории доставляют в клинику, где они находятся в специальных растворах при температуре 4 °С.
Полное приживление тканей и органов наблюдают при аутотрансплантации, пересадке от однояйцовых близнецов (сингенная, или изотрансплантация). При аллоили ксеногенной пересадке развивается реакция отторжения - реакция трансплантационного иммунитета.
Реакция трансплантационного иммунитета
Реакция трансплантационного иммунитета (реакция трансплантат против хозяина - РТПХ) развивается у реципиента в течение 7-10 сут после пересадки и направлена на отторжение трансплантата. В реакции отторжения непосредственную роль играют клетки иммунной системы, в частности Т-киллеры, но в реализации процесса участвуют макрофаги и Т-лимфоциты.
В первые 4-5 сут после трансплантации происходит приживление пересаженной ткани, иммунокомпетентные клетки реципиента в этот период идентифицируют чужой антиген. С 4-5-х суток в пересаженной ткани нарушается микроциркуляция, развивается отёк, начинается инвазия пересаженного органа мононуклеарными клетками. Т-лимфоциты приобретают цитотоксические свойства, а система В-лимфоцитов синтезирует антитела, в результате аллотрансплантат или ксенотрансплантат отторгается. Повторная аллотрансплантация от одного и того же донора вызывает трансплантационную иммунную реакцию в 2 раза быстрее, поскольку организм уже сенсибилизирован.
Современная иммунологическая концепция пересадки тканей и органов связана с взаимодействием субпопуляций Т- и В-лимфоцитов, где ведущую роль отводят субпопуляции Т-лимфоцитов (хелперным, киллерным и супрессорным клеткам).
Каждый живой организм обладает определённым иммунным статусом, его оценка создаёт основу для типирования иммунной совместимости донора и реципиента. Согласно основным законам генетики, каждый индивид имеет антигены HLA-сублокуса, относимые к антигенам тканевой совместимости, они локализуются в клеточных мембранах. Наличие нескольких SD- и LD-детерминант HLA-комплекса определяет трудности, сопровождающие подбор совместимых донора и реципиента. Вероятность подбора идентичного генотипа составляет не более 1:640 000.
Подбор донора и реципиента основан на иммунологическом типировании по основным системам антигенов: AB0, Rh (антигены эритроцитов) и HLA (антигены лейкоцитов - антигены гистосовместимости). Создание банков органов, которые берут на учёт и регистрируют тысячи реципиентов, облегчает подбор органов. Специальные карты реципиентов содержат полную информацию об иммунологическом, гематологическом и клиническом состоянии реципиентов. В Европе действует несколько таких банков.
С целью повышения эффективности аллотрансплантации проводят различные мероприятия.
• Неспецифическая иммунодепрессия - блокада иммунокомпетентной системы реципиента антимитотическими агентами (азатиоприном), глюкокортикоидами (преднизолоном) и антилимфоцитными сыворотками. В результате такого воздействия у реципиентов формируется состояние иммунодефицита и резко снижается устойчивость к инфекциям.
• Замена гематолимфоидной системы реципиента до аллотрансплантации путём тотального радиационного угнетения лимфоидной ткани с последующей пересадкой костного мозга донора.
• Селективная элиминация Т-киллерных клеток с одновременной стимуляцией активности Т-супрессорных клеток. Подобным избирательным действием характеризуется циклоспорин.
С точки зрения совместимости тканей идеальна трансплантация собственного органа или тканей.
Реплантация
Реплантация оторванной конечности или её фрагмента возможна в первые 6 ч после травмы при условии хранения оторванной конечности при температуре 4 °С, с перфузией её сосудов перед пересадкой. После первичной хирургической обработки восстанавливают кость, затем производят пластику вены и артерии, после этого сшивают нервы, мышцы, сухожилия, фасции, кожу. В послеоперационном периоде принимают меры для предупреждения синдрома травматического токсикоза, используя гипотермию, абактериальную среду.
Трансплантация почек
Трансплантацию почек широко применяют в настоящее время. Показание к трансплантации почки - её функциональная недостаточность с нарастающей уремией. Почку обычно пересаживают в гетеротопической позиции - её размещают ретроперитонеально в подвздошной ямке. Кровоток восстанавливают путём анастомозирования сосудов донорской почки с общей подвздошной артерией и веной реципиента; мочеточник имплантируют в мочевой пузырь (рис. 186). До операции и в ближайшем послеоперационном периоде проводят сеансы гемодиализа для уменьшения уремии. Признак отторжения почки - появление лимфоцитотоксинов в крови и лимфоцитов в моче.
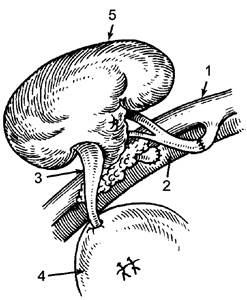
Рис. 186. Гетеротопическая трансплантация почки: 1 - подвздошная артерия; 2 - подвздошная вена; 3 - мочеточник; 4 - мочевой пузырь; 5 - пересаженная почка.
Трансплантация печени
Показание к трансплантации печени - её бурно прогрессирующая недостаточность (цирроз, злокачественные опухоли, атрезия жёлчных путей у новорождённых).
После удаления печени реципиента аллогенную печень трансплантируют в нормальное ложе в правом верхнем секторе брюшной полости (ортотопическая трансплантация).
При гетеротопической трансплантации донорскую печень размещают в другой области брюшной полости реципиента.
Функции печени на непродолжительный период можно поддержать кратковременной экстракорпоральной перфузией печени трупа или животного (свиньи, теленка).
Трансплантация сердца
Трансплантацию сердца выполняют при тяжёлой сердечной недостаточности, связанной прежде всего с прогрессирующей кардиомиопатией, аневризмами левого желудочка сердца, некорригируемыми врождёнными пороками сердца, включающими двухкамерное сердце, атрезию правого предсердно-желудочкового (трёхстворчатого) клапана и др.
Обоснованием пересадки сердца в клинике послужили экспериментальные исследования А. Карреля (1905) и В.П. Демихова (1946-1960). А. Кантровиц в Нью-Йорке повторил подобную операцию у грудного ребёнка. Позже выяснилось, что первая попытка трансплантации сердца была сделана в 1964 г. в штате Миссисипи американцем Дж. Харди, выполнившим ксенотрансплантацию сердца шимпанзе 68-летнему больному.
Сердце имплантируют в ортотопической позиции (на место удалённого органа) в условиях искусственного кровообращения. У реципиента оставляют заднюю стенку обоих предсердий с устьями полых вен, сохраняя таким образом зону автономной иннервации сердца. Трансплантацию начинают со сшивания задней стенки левого предсердия, межпредсердной перегородки и правого предсердия, далее соединяют аорту и лёгочный ствол.
Признаки отторжения сердца сначала выявляют на ЭКГ (тахикардия, экстрасистолия, уменьшение вольтажа зубцов). Повторные эндокардиальные биопсии сердца подтверждают диагноз.
Определённое значение имеет применение механического сердца. В настоящее время искусственное сердце с пневмоприводом используют для кратковременного замещения сердца при отсутствии донорского.
Трансплантация эндокринных желёз
В клинике используют пересадку щитовидной железы, гипофиза, надпочечников, яичка, поджелудочной железы.
Свободную пересадку эндокринных желёз выполняют давно, но функции желёз реализуются лишь до рассасывания имплантированных тканей. Трансплантация эндокринных желёз на сосудистой ножке сохраняет полностью структуру и функции железы.
Взятие эндокринных желёз для трансплантации выполняют в первые 6-10 ч после смерти. При этом выделяют сосудистую ножку железы с промыванием сосудов специальными растворами и затем замораживают при температуре -196 °С. Чаще всего сосуды желёз анастомозируют с бедренной или плечевой артерией. Функциональный эффект трансплантации проявляется отчетливо: после проведённой трансплантации яичка у мужчин исчезают заторможённость и инертность, появляется эякуляция; у женщин после пересадки яичников появляются менструации; при микседеме оказывается эффективной трансплантация щитовидной железы; тетанию, судороги устраняет пересадка паращитовидных желёз; при несахарном диабете трансплантация гипофиза значительно уменьшает чувство жажды. Кроме эффективной трансплантации поджелудочной железы (тела, хвоста, долей) с сосудистым анастомозом в подвздошной ямке, гормональный эффект удалось получить при трансплантации изолированных островков Лангерханса или мельчайших фрагментов поджелудочной железы в печень через воротную вену.
Технические вопросы трансплантации органов в современных условиях решены, но абсолютный успех возможен лишь после разрешения проблемы тканевой совместимости.
Дата добавления: 2017-09-19; просмотров: 1091;
