АНТИТЕЛА - это белки глобулиновой фракции крови, которые специфически соединяются с антигенами, вызвавшими их образование.
Они называются иммуноглобулинами и обозначаются Ig.По химическому составу они являются гликопротеидами (белок + углевод) и образуются В-лимфоцитами (плазматическими клетками).
Функции антител:1) участвуют в реакциях образования комплексов антиген-антитело в результате чего происходит связывание, нейтрализация и выведение антигена из организма;
2) усиливают фагоцитоз вместе с другими опсонинами;
3) активация комплемента;
4) входят в состав рецепторов В-лимфоцитов.
Основные свойства антител:
1) гетерогенность – способность вырабатывать на одну молекулу антигена столько антител, сколько у антигена эпитопов;
2) специфичность - способность антител вступать в реакцию только с тем антигеном, на который выработалось данное антитело.
Структура антител
По химическому составу иммуноглобулины относятся к гликопротеидам, т.к. их молекула состоит из протеина и углеводов.
Ig характеризуют по молекулярной массе, константе седиментации и т.п. Различия этих свойств позволили разделить их на 5 классов: IgG, IgM, IgA, IgE и IgD. IgM, G, А имеют подклассы. Все классы и подклассы различаются по аминокислотным последовательностям.
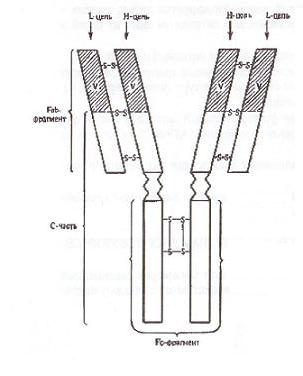 Структурной единицей антител является мономер, состоящий из четырех полипептидных цепей - двух тяжелых Н-цепей (от англ. heavy - тяжелый) и двух легких L-цепей (от англ. light - легкий), соединенных между собой дисульфидными мостиками -S-S-. Легкие и тяжелые цепи отличаются по молекулярной массе: мол. масса L-цепей 23000, мол. масса Н-цепей 50000-70000. Соответственно каждому классу иммуноглобулинов М, G, A,E, D различают пять типов тяжелых цепей: μ (мю), γ (гамма), α (альфа), ε (эпсилон), δ (дельта). Легкие цепи всех пяти классов являются общими и бывают двух типов: κ (каппа) и λ (лямбда). В одной и той же молекуле могут быть только идентичные L-цепи.
Структурной единицей антител является мономер, состоящий из четырех полипептидных цепей - двух тяжелых Н-цепей (от англ. heavy - тяжелый) и двух легких L-цепей (от англ. light - легкий), соединенных между собой дисульфидными мостиками -S-S-. Легкие и тяжелые цепи отличаются по молекулярной массе: мол. масса L-цепей 23000, мол. масса Н-цепей 50000-70000. Соответственно каждому классу иммуноглобулинов М, G, A,E, D различают пять типов тяжелых цепей: μ (мю), γ (гамма), α (альфа), ε (эпсилон), δ (дельта). Легкие цепи всех пяти классов являются общими и бывают двух типов: κ (каппа) и λ (лямбда). В одной и той же молекуле могут быть только идентичные L-цепи.
Как в Н- так и в L-цепях имеется вариабельная V-часть (от англ. various -разный), в которой последовательность аминокислот непостоянна. Остальная часть Н- и L-цепей называется константной С-частью (от англ. constant - постоянный).
При обработке меркаптоэтанолом разрушаются дисульфидные связи, и молекула иммуноглобулина распадается на отдельные цепи полипептидов.
При воздействии протеолитическим ферментом - папаином Ig распадается на три фрагмента: два некристаллизующихся, содержащих антигенсвязывающие центры (активные центры) и названных Fab-фрагментами I и II (от англ. fragment antigen binding – фрагменты, связывающие антиген) и один Fc-фрагмент кристаллизующийся (от англ. fragment crystalizable). Fab-I и Fab-II фрагменты сходны по свойствам и аминокислотному составу и отличаются от Fc-фрагмента. Fab- и Fc-фрагменты соединены между собой гибкими участками Н-цепи (шарнир), благодаря чему молекулы Ig имеют гибкую структуру.
Активный центр (антигенсвязывающий) образован вариабельными концевыми участками легких и тяжелых цепей (V-частъ) и представляет собой полость, пространственная конфигурация которой в точности повторяет пространственную конфигурацию антигенной детерминанты (как перчатка повторяет форму руки). Активный центр занимает около 2% поверхности молекулы Ig.
Соединение антигена с антителом обеспечивают ван-дер-ваальсовы силы, гидрофобные и электростатические взаимодействия, водородные связи.
Таким образом, каждый активный центр формируется двумя цепями - легкой и тяжелой, т.е. полноценной активностью антител ни одна из цепей в отдельности не обладает.
Валентность антитела определяется числом его активных центров.
Полные антитела имеют не менее двух активных центров. Они могут связать две молекулы антигена, образуя сетевую структуру (конгломераты), которая выпадает в осадок (видимые изменения).
Неполные антитела имеют один функциональный активный центр, они не образуют сетевой структуры иммунных комплексов (АГ+АТ), т.е. осадка не образуют.
Моноклональные антитела распознают только одну антигенную детерминанту.
Поликлональные антитела (например, сыворотки) распознают несколько антигенных детерминант в составе антигена.
Дата добавления: 2017-01-13; просмотров: 2631;
