Многоатомные спирты
Одноатомные спирты
Общая формула предельных одноатомных спиртов: СnH2n+1OH.
Номенклатура
Используются два возможных названия класса спиртов: “спирты” (от лат. “ спиритус” – дух) и “алкоголи” (арабск.).
По международной номенклатуре название спиртов образуется от названия соответствующего углеводорода с добавлением суффикса ол:
СН3ОН метанол
С2Н5ОН этанол и т.д.
Главная цепь углеродных атомов нумеруется с того конца, ближе всего к которому расположена гидроксильная группа:
5СН3 – 4СН – 3СН2 – 2СН2 – 1СН2-ОН
ç
СН3
4-метилпентанол-2
Изомерия спиртов
Строение спиртов зависит от строения радикала и положения функциональной группы, т.е. в гомологическом ряду спиртов может быть два вида изомерии: изомерия углеродного скелета и изомерия положения функциональной группы.
Кроме этого, третьим видом изомерии спиртов является межклассовая изомерия с простыми эфирами.
Так, например, для пентанолов (общая формула С5Н11ОН) характерны все 3 указанных типа изомерии:
1. Изомерия скелета
СН3 – СН2 – СН2 – СН2 – СН2 – ОН
пентанол-1
СН3– СН – СН2 – СН2 –ОН
ç
СН3
3-метилбутанол-1
СН3– СН2 – СН – СН2 –ОН
ç
СН3
2-метилбутанол-1
СН3
ç
СН3 – СН – СН2 – ОН
ç
СН3
2,2-диметилпропанол-1
Приведенные выше изомеры пентанола, или амилового спирта, носят тривиальное название “сивушные масла”.
2. Изомерия положения гидроксильной группы
СН3 – СН2 – СН2 – СН2 – СН2 – ОН
пентанол-1
СН3– СН – СН2 – СН2 –СН2
ç
ОН
пентанол-2
СН3– СН2 – СН – СН2 –СН2
ç
ОН
пентанол-3
3. Межклассовая изомерия
С2Н5 – О – С3Н7
этилпропиловый эфир
Число изомеров в ряду спиртов быстро растет: спирт с 5 атомами углерода имеет 8 изомеров, с 6 атомами углерода – 17, с 7 атомами углерода – 39, а с 10 атомами углерода – 507.
Способы получения спиртов
1. Получение метанола из синтез-газа
4000С, ZnO, Cr2O3
СО + 2Н2¾¾¾¾¾® СН3ОН
2. Гидролиз галогенуглеводородов (в водных растворах щелочей):
СН3 – СН – СН3 + КOНводный ® СН3 – СН – СН3 + КCl
½ ½
Cl ОН
2-хлорпропан пропанол-2
3. Гидратация алкенов. Реакция идет по правилу В.В. Марковникова. Катализатором является разбавленная Н2SO4.
СН2 = СН2 + НОН ® СН3 – СН2 - ОН
этилен этанол
СН2 = СН – СН3 + НОН ® СН2 – СН – СН3
½ ½
Н ОН
пропен пропанол-2
4. Восстановление карбонильных соединений (альдегидов и кетонов).
При восстановлении альдегидов получаются первичные спирты:
СН3 – СН2 – С = О + Н2® СН3 – СН2 – СН2 – ОН
½
Н
пропанол-1 пропаналь
При восстановлении кетонов получаются вторичные спирты:
CH3 – C – CH3 + Н2 ® СН3 – СН – СН3
II ½
О ОН
пропанон (ацетон) пропанол-2
5. Получение этанола брожением сахаристых веществ:
ферменты ферменты
С12Н22О11 + Н2О ¾¾¾® 2С6Н12О6 ¾¾¾® 4С2Н5ОН + 4СО2
сахароза глюкоза этанол
ферменты ферменты
(С6Н10О5)n + Н2О ¾¾¾® nС6Н12О6 ¾¾¾® С2Н5ОН + СО2
целлюлоза глюкоза этанол
Спирт, полученный брожением целлюлозы, называется гидролизным спиртом и применяется только для технических целей, т.к. содержит большое количество вредных примесей: метанола, уксусного альдегида и сивушных масел.
6. Гидролиз сложных эфиров
Н+ или ОН–
СН3 – С – О– СН2 – СН2 –СН3 + Н2О ¾¾® СН3 – С – ОН + ОН – СН2 – СН2 –СН3
ll ll
О О
пропиловый эфир уксусной кислоты уксусная пропанол-1
(пропилэтаноат) кислота
7. Восстановление сложных эфиров
4[Н]
СН3 – С – О– СН2 – СН2 –СН3 ¾¾® СН3 – СH2 – ОН + ОН – СН2 – СН2 –СН3
ll
О
пропиловый эфир уксусной кислоты этанол пропанол-1
(пропилэтаноат)
Физические свойства спиртов
Предельные спирты, содержащие от 1 до 12 атомов углерода, представляют собой жидкости; от 13 до 20 атомов углерода – маслообразные (мазеобразные) вещества; более 21 атома унлерода – твердые вещества.
Низшие спирты (метанол, этанол и пропанол) имеют специфический алкогольный запах, бутанол и пентанол – сладкий удушливый запах. Спирты, содержащие более 6 атомов углерода, запаха не имеют.
В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С увеличением молекулярной массы растворимость спиртов в воде падает.
Существенно более высокая температура кипения спиртов по сравнению с углеводородами, содержащими такое же число атомов углерода (например, tкип (СН4) = – 1610С, а tкип (СН3ОН) = 64,70С) связана со способностью спиртов образовывать водородные связи, а следовательно, и способностью молекул к ассоциации.
××× Н – О ×××Н – О ×××Н – О ×××R – радикал спирта
\ \ \
R R R
При растворении спирта в воде также возникают водородные связи между молекулами спирта и воды. В результате этого процесса происходит выделение энергии и уменьшение объема. Так, при смешении 52 мл этанола и 48 мл воды общий объем образующегося раствора будет не 100 мл, а лишь 96,3 мл.
Пожарную опасность представляют как чистые спирты (особенно низшие), пары которых могут образовывать взрывоопасные смеси, так и водные растворы спиртов. Водные растворы этанола в воде с концентрацией спирта более 25 % и более являются легковоспламеняющимися жидкостями.
Химические свойства спиртов
Химические свойства спиртов определяются реакционной способностью гидроксильной группы и строением радикала, связанного с гидроксильной группой.
1. Реакции гидроксильного водорода R – О – Н
За счет электроотрицательности атома кислорода в молекулах спиртов имеет место частичное распределение зарядов:
d– d+
R – О – Н
Водород обладает определенной подвижностью и способен вступать в реакции замещения.
1.1. Взаимодействие со щелочными металлами – образование алкоголятов:
2СН3 – СН – СН3 + 2Na ® 2СН3 – СН – СН3 + Н2
½ ½
ОН ОNa
пропанол-2 изопропилат натрия
(натриевая соль пропанола-2)
Соли спиртов (алкоголяты) представляют собой твердые вещества. При их образовании спирты выступают как очень слабые кислоты.
Алкоголяты легко подвергаются гидролизу:
С2Н5ОNa + НОН ® С2Н5ОН + NaОН
этилат натрия
1.2. Взаимодействие с карбоновыми кислотами (реакция этерификации) - образование сложных эфиров:
Н2SO4 конц.
СН3 – СН – ОН + НО – С – СН3 ¾¾® СН3 – СН – О – С – СН3 + Н2О
½ ll ½ ll
СН3 О СН3 О
уксусная кислота изопропилацетат
(изопропиловый эфир
уксусной кислоты)
1.3. Взаимодействие с неорганическими кислотами:
СН3 – СН – ОН + НО –SO2OH ® СН3 – СН – О – SO2OH + H2O
½ ½
CH3 CH3
серная кислота изопропилсерная кислота
(изопропиловый эфир
серной ксилоты)
1.4. Межмолекулярная дегидратация – образование простых эфиров:
Н2SO4 конц., t<1400C
СН3 – СН – ОН + НО – СН – СН3 ¾¾¾® СН3 – СН – О – СН – СН3 + Н2О
½ ½ ½ ½
СН3 СН3 СН3 СН3
диизопропиловый эфир
2. Реакции гидроксильной группы R – ОН
2.1. Взаимодействие с галогеноводородами:
Н2SO4 конц.
СН3 – СН – СН3 + HCl ¾¾® СН3 – СН – СН3 + H2O
½ ½
OH Cl
2-хлорпропан
2.2. Взаимодействие с галогенпроизводными фосфора:
СН3 – СН – СН3 + РCl5 ¾® СН3 – СН – СН3 + РОCl3 + НCl
½ ½
OH Cl
2-хлорпропан
2.3. Внутримолекулярная дегидратация – получение алкенов:
Н2SO4 конц.,t>1400C
СН3 – СН – СН2 ¾¾¾® СН3 – СН = СН2 + Н2О
½ ½ пропен
ОН Н
При дегидратации несимметричной молекулы отщепление водорода идет преимущественно от наименее гидрогенизированного атома углерода (правило А.М. Зайцева).
3. Реакции окисления.
3.1. Полное окисление – горение:
С3Н7ОН + 4,5О2® 3СО2 + 4Н2О
Частичное (неполное) окисление.
Окислителями могут быть перманганат калия КMnO4, смесь бихромата калия с серной кислоты K2Cr2O7 + H2SO4, медный или платиновый катализаторы.
При окислении первичных спиртов образуются альдегиды:
ОH
½
СН3 – СН2 – СН2 – ОН + [O] ® [СН3 – С – ОН] ® СН3 – СН2 – С = О + Н2О
½ ½
H Н
пропанол-1 пропаналь
Реакция окисления метанола при попадании этого спирта в организм – пример так называемого “ летального синтеза”. Сам метиловый спирт является относительно безвредным веществом, но в организме в результате окисления он превращается в чрезвычайно ядовитые вещества: метаналь (формальдегид) и муравьиную кислоту. В результате попадание в организм уже 10 г метанола приводит к потере зрения, а 30 г – к смерти.
Реакция спирта с оксидом меди (II) может использоваться как качественная реакция на спирты, т.к. в результате реакции меняется окраска раствора.
СН3 – СН2 – СН2 – ОН + CuO ® СН3 – СН2 – С = О + Cu¯ + Н2О
½
H
пропанол-1 пропаналь
В результате частичного окисления вторичных спиртов образуются кетоны:
OH
½
СН3 – СН – СН3 + [O] ® СН3 – С – СН3 + Н2О
ll
О
пропанол-2 пропанон
(ацетон)
Третичные спирты при таких условиях не окисляются, а при окислении в более жестких условиях происходит расщепление молекулы, и при этом образуется смесь карбоновых кислот.
Применение спиртов
Спирты используют в качестве прекрасных органических растворителей.
Метанол получают в большом объеме и используют для приготовления красителей, незамерзающих смесей, как источник для производства различных полимерных материалов (получение формальдегида). Следует помнить, что метанол сильно токсичен.
Этиловый спирт – первое органическое вещество, которое было выделено в чистом виде в 900 г. в Египте.
В настоящее время этанол – многотоннажный продукт химической промышленности. Он применяется для получения синтетического каучука, органических красителей, изготовления фармацевтических препаратов. Кроме этого, этиловый спирт используется как экологически чистое горючее. Этанол употребляется при изготовлении алкогольных напитков.
Этанол – наркотик, возбуждающе действующий на организм; его длительное и неумеренное употребление приводит к алкоголизму.
Бутиловые и амиловые спирты (пентанолы) используются в промышленности как растворители, а также для синтеза сложных эфиров. Все они обладают значительной токсичностью.
Спирты, содержащие в радикале более 10 атомов углерода, относятся к высшим алифатическим спиртам. В свободном виде в природе они не встречаются, а встречаются в виде сложных эфиров в восках, кашалотовом и шерстяном жирах. Высшие жирные спирты применяются для изготовления поверхностно-активных веществ.
Многоатомные спирты
Многоатомные спирты содержат в своем составе две или более гидроксильных групп у разных углеродных атомов.
СН2 – СН2 СН2 – СН – СН2 СН2 – СН – СН – СН – СН2
ç ç ç ç ç ç ç ç ç ç
ОН ОН ОН ОН ОН ОН ОН ОН ОН ОН
этандиол-1,2 пропантриол-1,2,3 пентанпентол-1,2,3,4,5
(этиленгликоль) (глицерин) (ксилит)
Физические свойства многоатомных спиртов
Этиленгликоль (“гликоли” – общее название двухатомных спиртов) представляет собой бесцветную вязкую жидкость, хорошо растворяется в воде и во многих органических растворителях.
Глицерин – важнейший трехатомный спирт – бесцветная, густая, хорошо растворимая в воде жидкость. Глицерин известен с 1779 года после открытия его шведским химиком К Шееле.
Многоатомные спирты, содержащие 4 и более атомов углерода, представляют собой твердые вещества.
Чем больше в молекуле гидроксильных групп, тем лучше оно растворяется в воде и тем выше его температура кипения. Кроме этого, появляется сладкий вкус, причем, чем больше гидроксильных групп в веществе, тем более сладким оно является.
В качестве заменителей сахара используются такие вещества как ксилит и сорбит:
СН2 – СН – СН – СН – СН2 СН2 – СН – СН – СН – СН – СН2
ç ç ç ç ç ç ç ç ç ç ç
ОН ОН ОН ОН ОН ОН ОН ОН ОН ОН ОН
ксилит сорбит
Шестиатомный спирт “инозит” также сладкий на вкус. Инозит содержится в бобовых, почках, печени, мышцах. Инозит имеет общую формулу с глюкозой:
СН – ОН
/ \
НО –НС СН – ОН
ç ç
НО –НС СН – ОН С6Н12О6.
\ /
СН– ОН
циклогексангексол
(инозит)
Способы получения многоатомных спиртов
1. Неполное окисление алкенов
Частичное окисление раствором перманганата калия КMnО4.
1.1. Окисление этилена
СН2 = СН2 + [O]+ НОН ® СН2– СН2
этилен ½ ½
OН ОН
этандиол-1,2
(этиленгликоль)
1.2. Окисление пропена
СН2 = СН – СН3 + [O]+ НОН ® СН2– СН – СН2
пропен ½ ½ ½
OН ОН ОН
пропантриол-1,2,3,
(глицерин)
2. Омыление растительных и животных жиров
Глицерин получают в качестве побочного продукта в мыловаренной промышленности при переработке жиров.
СН2 – О – ОС – С17Н35 СН2 – ОН
½ ½
СН – О – ОС – С17Н35 + 3NaOH® СН – ОН + 3 С17Н35СООNa
½ ½
СН2 – О – ОС – С17Н35 СН2 – ОН
триглицерид глицерин стеарат натрия
стеариновой кислоты (мыло)
Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов во многом аналогичны свойствам одноатомных спиртов.
1. Взаимодействие с активными металлами
СН2 – ОН СН2 – ОNa
ç + 2Na®ç + H2
СН2 – ОН СН2 – ОNa
этиленгликоль натриевая соль этиленгликоля
2. Образование сложных эфиров с минеральными кислотами
СН2 – ОН + НО – NО2 СН2 – О– NО2
½ ½
СН – ОH + НО – NО2 ® СН – О– NО2 + 3Н2О
½ ½
СН2 – ОH + НО – NО2 СН2 – О– NО2
глицерин азотная тринитроглицерин
кислота
Тринитроглицерин – одно из сильнейших взрывчатых веществ, взрывается от удара, сотрясения, запала, в результате саморазложения. Для практического применения с целью повышения безопасности при работе с тринитроглицерином его переводят в динамит (пропитанные тринитроглицерином пористые материалы – инфузорная земля, древесная мука и т.п.).
3. Взаимодействие с гидроксидом меди (II) – качественная реакция на глицерин
СН2 – ОН СН2 – ОmН / О – СН2
ç ç Cuj ç
2 СН – ОН + Cu(ОН)2® СН – О / НО – С Н
ç ç ç
СН2 – ОН СН2 – ОН НО – СН2
диглицерат меди
(ярко-синяя окраска)
4. Дегидратация глицерина с образованием акролеина
t
С3Н8О3® СН2 = СН – С = О + 2Н2О
глицерин ç
Н
акролеин (удушливый запах при прокаливании жиров)
5. Реакции окисления
Этиленгликоль и глицерин при взаимодействии с сильными окислителями (перманганатом калия КMnО4, оксидом хрома (VI) CrO3) склонны к самовозгоранию.
- 2/3 +7 +4 +2
5С3Н8О3 + 14КMnО4 + 21H2SO4® 15CO2 + 14MnSO4 + 7K2SO4 + 41H2O
Применение многоатомных спиртов
Этиленгликоль и глицерин используют для изготовления незамерзающих жидкостей – антифризов. Так, водный 50 %-ный раствор глицерина замерзает только при – 340С, а раствор, составленный из 6 частей этиленгликоля и 1 части воды замерзает при температуре – 490С.
Пропиленгликоль СН3 – СН(ОН) – СН2 – СН2ОН используется для получения не содержащих воду пен (такие пены более стабильны), а также является составной частью кремов для загара.
Этиленгликоль используется для получения волокна “лавсан”, а глицерин – для получения глифталевых смол.
В большом количестве глицерин используется в парфюмерной, медицинской и пищевой промышленности.
Фенолы
Фенолы – производные ароматических углеводородов, у которых гидроксильная группа ОН- присоединена непосредственно к углеродному атому бензольного кольца.
Гидроксильная группа связана с ароматическим радикалом (фенилом). p-электроны бензольного кольца вовлекают неподеленные электроны атома кислорода ОН-группы в свою систему, в результате чего водород гидроксильной группы становится более подвижным, чем в алифатических спиртах.
| ОН ç С // \ HС СH ç çç HС СH \\ / СH | ОН ç С // \ HС С – СН3 ç çç HС СН \\ / СH | ОН ç С // \ HС СH ç çç HС С– ОН \\ / СH | ОН ç С // \ HС СH ç çç HС СH \\ / С ç ОН |
| С6Н5ОН | о- крезол | резорцин | гидрохинон |
| фенол | |||
| одноатомные фенолы | двухатомные фенолы |
Физические свойства
Простейший представитель – фенол – представляет собой бесцветное кристаллическое вещество (температура плавления 420С) с характерным запахом. Тривиальное название фенола – карболовая кислота.
Одноатомные фенолы в воде труднорастворимы, с увеличением числа гидроксильных групп растворимость в воде увеличивается. Фенол при температуре 600С в воде растворяется неограниченно.
Все фенолы сильно ядовиты. Фенол при попадании на кожу вызывает ожоги.
Способы получения фенола
1. Получение из каменноугольной смолы
Это важнейший технический способ получения фенола. Он состоит в том, что фракции каменноугольной смолы, полученные при коксовании каменного угля, обрабатываются щелочами, а затем для нейтрализации – кислотами.
2. Получение из галогенпроизводных бензола
С6Н5Cl + NaOHконц. водн. р-р ® С6Н5ОН + NaCl
хлорбензолфенол
Химические свойства фенолов
1. Реакции с участием гидроксильного водорода С6Н5 – О – Н
1.1. Взаимодействие с активными металлами
2С6Н5ОН + 2Na® 2C6H5ONa + H2
фенол фенолят
натрия (соль)
1.2. Взаимодействие с щелочами
Фенол является более сильной кислотой, чем одноатомные спирты и поэтому в отличие от последних фенол реагирует с растворами щелочей:
С6Н5ОН + NaОН ® C6H5ONa + H2О
фенол фенолят
натрия
Фенол является более слабой кислотой, чем угольная кислота Н2СО3 (примерно в 300 раз) или сероводородная кислота Н2S, поэтому феноляты разлагаются слабыми кислотами:
C6H5ONa + H2О + СО2 ® С6Н5ОН + NaНСО3
1.3. Образование простых и сложных эфиров
Н2SO4 конц.
С6Н5ОН + НО – С2Н5¾¾¾®C6H5O – С2Н5 + H2О
2. Реакции с участием бензольного кольца
Фенол без нагревания и без катализаторов энергично вступает в реакции замещения атомов водорода, при этом почти всегда образуются тризамещенные производные
2.1. Взаимодействие с бромной водой – качественная реакция на фенол
| ОН ½ С // \ НС СН ç çç HС СН \\ / СH фенол | + 3Br2 (водн.) ¾® | ОН ½ С // \ Br–С С– Br ç çç HС СН \\ / С ½ Br 2,4,6-трибромфенол (белый осадок) | + 3HBr |
2.2. Взаимодействие с азотной кислотой
| ОН ½ С // \ НС СН ç çç HС СН \\ / СH фенол | Н2SO4 конц. ¾® 3НО – NO2 | ОН ½ С // \ О2N–С С– NO2 ç çç HС СН \\ / С ½ NO2 2,4,6-тринитрофенол (пикриновая кислота) | + 3H2O |
Пикриновая кислота – желтое кристаллическое вещество. При осторожном нагревании плавится при температуре 1220С, а при быстром нагревании – взрывается. Соли пикриновой кислоты (пикраты) взрываются при ударе и трении.
3. Реакция поликонденсации с формальдегидом
Взаимодействие фенола с формальдегидом с образованием смолообразных продуктов было изучено еще в 1872 г. Байером. Широкое практическое применение эта реакция получила значительно позже – в 20 – 30-х годах 20 века, когда во многих странах из фенола и формальдегида стали готовить так называемые бакелиты.
4. Реакция окрашивания с хлорным железом
Все фенолы при взаимодействии с хлорным железом FeCl3 образуют окрашенные соединения; одноатомные фенолы дают окрашивание фиолетового или синего цвета. Эта реакция может служить качественной реакцией на фенол.
Применение фенолов
Фенолы убивают многие микроорганизмы, чем пользуются в медицине, применяя фенолы и их производные как дезинфицирующие и антисептические средства. Фенол (карболовая кислота) был первым антисептическим средством, введенным в хирургию Листером в 1867 году. Антисептические свойства фенолов основаны на их способности свертывать белки.
“Фенольный коэффициент” – число, показывающее, во сколько раз антисептическое действие данного вещества больше (или меньше) действия фенола, принимаемого за единицу. Гомологи бензола – крезолы – обладают более сильным бактерицидным действием, чем сам фенол.
Фенол используют для получения фенолформальдегидных смол, красителей, пикриновой кислоты, а также из него получают лекарственные препараты, такие как салицилаты, аспирин и другие.
Одним из наиболее известных производных двухатомных фенолов является адреналин. Адреналин является гормоном, образующимся в надпочечниках, и обладает способностью сужать кровеносные сосуды. Его часто применяют в качестве кровоостанавливающего средства
| ОН ½ С // \ HС С – ОН ç çç HС СH \\ / С ½ НС – СН2 – NH – СН3 ½ ОН адреналин |
Вопрос № 3. Простые эфиры спиртов (20мин)
Простыми эфирами называются органические соединения, в которых два углеводородных радикала связаны между собой атомом кислорода. Простые эфиры можно рассматривать как продукты замещения атома водорода в гидроксиле спирта радикалом:
R – O – H ® R – O – R/
Общая формула простых эфиров СnH2n+2O.
Радикалы в молекуле простого эфира могут быть одинаковыми, например, в эфире СН3 – О – СН3, или же разными, например, в эфире СН3 – О – С3Н7. Эфир, имеющий различные радикалы, называется смешанным.
Номенклатура простых эфиров
Обычно эфиры называются по тем радикалам, которые входят в их состав (рациональная номенклатура).
По международной номенклатуре простые эфиры обозначают как производные углеводородов, в которых атом водорода замещен алкоксигруппой (RO –), например, метоксигруппой СН3О –, этоксигруппой С2Н5О – и т.д.
| Простой эфир | Рациональная номенклатура | Номенклатура ИЮПАК |
| СН3 – О – СН3 | диметиловый эфир | метокисметан |
| С2Н5 – О – С2Н5 | диэтиловый эфир | этоксиэтан |
| СН3 – О – С2Н5 | метилэтиловый эфир | метоксиэтан |
| С2Н5 – О – С3Н7 | этилпропиловый эфир | этоксипропан |
Изомерия простых эфиров
1. Изомерия простых эфиров определяется изомерией радикалов, связанных с кислородом.
С4Н10О
СН3 – О – СН2 – СН2 – СН3 метилпропиловый эфир
С2Н5 – О – С2Н5 диэтиловый эфир
СН3 - О – СН – СН3 метилизопропиловый эфир
½
СН3
2. Межклассовыми изомерами простых эфиров являются одноатомные спирты.
СН3 – СН2 – СН2 – СН2 – ОН
бутанол-1
Физические свойства простых эфиров
Диметиловый и метилэтиловый эфиры представляют собой при обычных условиях газообразные вещества.
Начиная с диэтилового эфира, вещества этого класса представляют собой бесцветные, легкоподвижные жидкости с характерным запахом.
Простые эфиры легче воды и почти не растворяются в ней. Из-за отсутствия водородных связей между молекулами, простые эфиры кипят при более низкой температуре, чем соответствующие спирты.
В органических растворителях простые эфиры растворяются легко и сами растворяют многие вещества.
Наиболее распространенным соединением этого класса является диэтиловый эфир С2Н5 – О – С2Н5, впервые полученный в XVI веке Кордусом. Очень часто его называют “серный эфир”. Это название, полученное в XVIII веке, связано со способом получения эфира: взаимодействием этилового спирта с серной кислотой.
Диэтиловый эфир – бесцветная, очень подвижная жидкость с сильным характерным запахом. Это вещество чрезвычайно взрывопожароопасно. Температура кипения диэтилового эфира 34,60С, температура замерзания 1170С. Эфир плохо растворим в воде (1 объем эфира растворяется в 10 объемах воды). Эфир легче воды (плотность 714 г/л). Диэтиловый эфир склонен к электризации: разряды статического электричества могут возникнуть в момент переливания эфира и послужить причиной его воспламенения. Пары диэтилового эфира в 2,5 раза тяжелее воздуха и образует с ним взрывоопасные смеси. Концентрационные пределы распространения пламени (КПР) 1,7 – 49 %.
Пары эфира могут распространяться на значительные расстояния, сохраняя при этом способность к горению. Основная мера предосторожности при работе с эфиром – это удаление от открытого огня и сильно нагретых приборов и поверхностей, включенных электрических плиток.
Температура вспышки эфира – 450С, температура самовоспламенения 1640С. При горении эфир горит синеватым пламенем с выделением большого количества тепла. Пламя эфира быстро увеличивается, т.к. верхний слой его быстро нагревается до температуры кипения. При горении эфир нагревается в глубину. Скорость роста нагретого слоя составляет 45 см/час, а скорость выгорания его со свободной поверхности 30 см/час.
При контакте с сильными окислителями (KMnO4, CrO3, галогены) диэтиловый эфир самовозгорается. Кроме этого, при контакте с кислородом воздуха диэтиловый эфир может образовывать перекисные соединения, которые являются чрезвычайно взрывоопасными веществами.
Способы получения простых эфиров
1. Межмолекулярная дегидратация спиртов
H2SO4 конц.
С2Н5 – ОН + НО – С2Н5 ¾¾¾® С2Н5 – О – С2Н5 + Н2О
этанол диэтиловый эфир
Химические свойства простых эфиров
1. Простые эфиры – довольно инертные вещества, не склонные к химическим реакциям. Однако при действии концентрированных кислот они разлагаются
С2Н5 – О – С2Н5 + НI конц.® С2Н5ОН + С2Н5I
диэтиловый этанол иодэтан
эфир
2. Реакции окисления
2.1.Полное окисление - горение:
С4Н10О + 6(О2 + 3,76N2) ® 4СО2 + 5Н2О + 6 × 3,76N2
2.2. Неполное окисление
При стоянии, особенно на свету, эфир под влиянием кислорода окисляется и разлагается с образованием ядовитых и взрывоопасных продуктов– перекисных соединений и продуктов их дальнейшего разложения.
Н ОН
\ /
О – С – СН3
С2Н5 – О – С2Н5 + 3[О] ® ½
О – С – СН3
/ \
НО Н
гидроперекись оксиэтила
Применение простых эфиров
Диэтиловый эфир является хорошим органическим растворителем. Его применяют для извлечения различных полезных веществ из растений, для чистки тканей, при изготовлении порохов и искусственного волокна.
В медицине эфир применяется для общего наркоза. Впервые с этой целью при проведении хирургической операции эфир был использован американским врачом Джексоном в 1842 году. За введение этого метода горячо боролся русский хирург Н.И. Пирогов.
Вопрос № 4. Карбонильные соединения (30 мин)
Альдегиды и кетоны – производные углеводородов, в молекулах которых содержится одна или более карбонильных групп 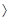 С = O.
С = O.
| Альдегиды | Кетоны |
| Альдегиды содержат карбонильную группу, связанную с одним радикалом и с одним атомом водорода – С = О ½ Н | Кетоны содержат карбонильную группу, связанную с двумя радикалами – С – ll О |
| Общая формула карбонильных соединений СnН2nО | |
| Номенклатура карбонильных соединений | |
| Название “альдегиды” произошло от общего способа получения этих соединений: дегидрирование спирта, т.е. отнятие у него водорода. По номенклатуре ИЮПАК название альдегидов производят от названий соответствующих углеводородов, добавляя к ним суффикс “аль”. Нумерацию цепи начинают от альдегидной группы. | По номенклатуре ИЮПАК название кетонов производят от названий соответствующих углеводородов, добавляя к ним суффикс “он”. Нумерацию ведут от ближайшего к карбонилу конца цепи. Первый представитель ряда кетонов содержит 3 атома углерода. |
| Н – С = О метаналь ½ (муравьиный альдегид, Н формальдегид) СН3– С = О этаналь ½ (уксусный альдегид, Н ацетальдегид) 5 4 3 2 1 СН3 – СН – СН2 – СН2 – С = О ½ ½ СН3 Н 4-метилпентаналь | СН3 – С – СН3 пропанон ll (ацетон) О 6 5 4 3 2 1 СН3 – СН2 – СН – СН2 – С – СН3 ½ ll СН3 О 4-метилгексанон-2 |
| Изомерия непредельных соединений | |
| 1. Изомерия углеродной цепи | |
| СН3 – СН2 – СН2 – СН2 – СН2 – С = О ½ гексаналь Н СН3 – СН – СН – С = О ½ ½ ½ СН3 СН3 Н 2,3-диметилбутаналь | СН3 – СН2 – СН2 – СН2 – СН2 – С – СН3 ll гептанон-2 О СН3 – СН2 – СН – С – СН3 ½ ll С2Н5 О 3-этилпентанон-2 |
| 2. Изомерия положения карбонильной группы | |
| СН3 – СН2 – СН2 – СН2 – СН2 – С – СН3 ll гептанон-2 О СН3 – СН2 – СН2 – С – СН2 – СН2 – СН3 ll гептанон-4 О | |
| 3. Альдегиды и кетоны являются межклассовыми изомерами | |
| Физические свойства карбонильных соединений | |
| Формальдегид (метаналь) при обычных условиях представляет собой газ с резким неприятным “острым” запахом, хорошо растворимый в воде. 40%-ный раствор формальдегида в воде называется формалином. Уксусный альдегид (этаналь) представляет собой летучую, легковоспламеняющуюся жидкость. Температура кипения его составляет 20,20С, температура вспышки -330С. В больших концентрациях он обладает неприятным удушливым запахом; в малых концентрациях имеет приятный запах яблок (в которых он и содержится в небольшом количестве). Уксусный альдегид хорошо растворим в воде, спирте, многих других органических растворителях. | Простейший кетон – пропанон (ацетон) – легковоспламеняющаяся жидкость. Последующие представители также являются жидкостями. Высшие алифатические ( > 10 атомов С), а также ароматические кетоны – твердые вещества. Ацетон имеет низкую температуру кипения 56,10С и температуру вспышки -200С. Простейшие кетоны смешиваются с водой. Опасность представляют и водные растворы ацетона. Так, 10 %-ный раствор его в оде имеет температуру вспышки 110С. Все кетоны хорошо растворимы в спирте и эфире. Простейшие кетоны обладают характерным запахом; средние гомологи имеют довольно приятный запах, напоминающий запах мяты. |
| Способы получения карбонильных соединений | |
| 1. Реакции частичного (неполного) окисления спиртов | |
| Первичные спирты при окислении дают альдегиды: СН3 – СН2 – СН2 – ОН + [O]® Н2О + пропанол-1 + СН3 – СН2 – С = О пропаналь ½ Н | Вторичные спирты при окислении образуют кетоны: СН3 – СН – СН2 –СН3 + [O] ® Н2О + ½ ОН + СН3 – С – СН2 – СН3 бутанол-2 ll О бутанон-2 |
| 2. Гидратация алкинов (реакция Кучерова) | |
| Альдегид получается только при гидратации ацетилена, во всех остальных случаях образуются кетоны. Hg2+ СН º СН + НОН ® СН3 – С = О + Н2О ацетилен ½ Н этаналь | Hg2+ СН º С – СН2 – СН3 + НОН ® Н2О + бутин-1 + СН3 – С – СН2 – СН3 ll О бутанон-2 |
| 3. Гидролиз дигалогенпроизводных. (Атомы галогенов расположены у одного и того же атома углерода). Реакция протекает в водном растворе щелочи. | |
| Cl ½ СН3 – СН2 – СН + 2КОН водный® Cl 1,1-дихлорпропан ® 2КCl + СН3 – СН2 – С = О + Н2О ½ Н пропаналь | Cl ½ СН3 – СН2 – С – СН3 + 2КОН водный® ½ Cl 2,2-дихлорбутан ® 2КCl + СН3 – СН2 – С – СН3 + Н2О ll О бутанон-2 |
| 4. Восстановление карбоновых кислот | |
| СН3 – СН2 – С = О + H2 ® ½ ОН пропановая кислота ® Н2О + СН3 – СН2 – С = О ½ Н пропаналь | |
| Химические свойства карбонильных соединений | |
| По химической активности альдегиды превосходят кетоны и являются более реакционноспособными. Радикалы, связанные с карбонильной группой, обладают так называемым положительным индукционным эффектом: они повышают электронную плотность связи радикала с другими группами, т.е. как бы гасят положительный заряд углеродного атома карбонила. Вследствие этого карбонильные соединения по убыли их химической активности можно расположить в следующий ряд: Н – Сd+– Н > Н3С ® Сd+ – Н > Н3С ® Сd+ СН3 II II II Оd- Оd- Оd- (прямые стрелки в формулах показывают сдвиг электронов, гашение положительно заряженного атома углерода карбонильной группы). | |
| 1. Реакции присоединения по месту разрыва двойной связи >C = О. Реакции восстановления. | |
| СН3 – СН2 – С = О + Н2® ½ Н пропаналь ® СН3 – СН2 – СН2 – ОН (пропанол-1) | CH3 – CН2 – С – CH3 + Н2® II О бутанон-2 ® CH3 – CН2 – СН – CH3 ½ ОН бутанол-2 |
| 2. Реакции окисления | |
| 2.1. Полное окисление – горение | |
| С3Н6О + 4О2® 3СО2 + 3Н2О | С4Н8О + 5,5О2® 4СО2 + 4Н2О |
| 2.2. Частичное (неполное) окисление | |
| Реакции окисления оксидом серебра ("реакция серебряного зеркала"), гидроксидом меди (II) – качественные реакции на альдегиды. NH3, t СН3 – СН2 – С = О + Ag2O ¾¾® ½ Н пропаналь ¾¾®2Ag¯ + СН3 – СН2 – С = О ½ ОН пропановая кислота В этом случае выпадает осадок серебра. СН3 – СН2 – С = О + 2Cu(OH)2® ½ Н пропаналь ® Cu2O + СН3 – СН2 – С = О + H2O ½ ОН пропановая кислота Голубой осадок гидроксида меди превращается в красный осадок закиси меди. | Окисление кетонов протекает очень трудно только сильными окислителями (хромовая смесь, КMnO4), в результате образуется смесь кислот: t CH3 – CН2 – С – CH3 + [O] ® II O бутанон-2 ® 2CH3 – C = O ½ OH уксусная (этановая) кислота или ® CH3 – СН2 – C = O + Н – С = О ½ ½ ОН ОН пропановая муравьиная кислота (метановая) кислота |
| При контакте с сильными окислителями (КMnO4, CrO3, HNO3 конц., Н2SO4 конц.) альдегиды и кетоны самовозгораются. | |
| 3. Реакции, обусловленные превращениями в радикалах. Замещение водорода в радикалах на галогены | |
| СН3 – С = О + Cl2 ® HCl + CH2Cl – С = О ½ ½ H Н этаналь хлоруксусный альдегид При хлорировании метаналя образуется ядовитый газ фосген: Н – С = О + 2Сl2®Cl – C = O + 2НCl ½½ HCl фосген | СН3 – С – СН3 + Br2® HBr + CH3 – C – CH2Br II II O O ацетон бромацетон Бромацетон и хлорацетон являются слезоточивыми боевыми отравляющими веществами (лакриматорами). |
| Применение карбонильных соединений | |
| Формальдегид применяют в промышленности для производства фенолформальдегидных и карбамидных полимеров, органических красителей, клеев, лаков, в кожевенной промышленности. Формальдегид в виде водного раствора (формалин) используется в медицинской практике. Ацетальдегид является исходным веществом для производства уксусной кислоты, полимерных материалов, лекарственных средств, эфиров. | Ацетон очень хорошо растворяет ряд органических веществ (например, лаки, нитроцеллюлозу и др.) и поэтому в больших количествах применяется как растворитель (производство бездымного пороха, искусственного шелка, красок, кинопленки). Ацетон служит сырьем для получения синтетического каучука. Чистый ацетон используют при экстрагировании пищевых продуктов, витаминов и лекарств, а также в качестве растворителя для хранения и перевозки ацетилена. |
Вопрос № 5. Карбоновые кислоты (30 мин)
Карбоновыми кислотами называются производные углеводородов, которые содержат одну или несколько карбоксильных групп – С = О.
½
ОН
Карбоксильная группа представляет собой сочетание карбонильной и гидроксильной групп: – С = О + – С – ® – С = О.
½ ½ ½
ОН ОН
карбонил + гидроксил ® карбоксил.
Карбоновые кислоты – продукты окисления альдегидов, которые, в свою очередь, являются продуктами окисления спиртов. На кислотах завершается процесс окисления (с сохранением углеродного скелета) в следующем ряду:
углеводород ® спирт ® альдегид ® карбоновая кислота.
Дата добавления: 2016-12-26; просмотров: 4820;
