Анализ смесей катионов
ХИМИЧЕСКИЙ АНАЛИЗ
Аналитическая химия. Химический анализ. Задачи и этапы анализа. Аналитический сигнал. Классификации методов анализа. Идентификация веществ. Дробный анализ. Систематический анализ.
Одной из задач при проведении природоохранных мероприятий является познание закономерностей причинно-следственных связей между различными видами человеческой деятельности и изменениями, происходящими в природной среде. Анализ - это главное средство контроля за загрязненностью окружающей среды. Научной основой химического анализа является аналитическая химия. Аналитическая химия - наука о методах и средствах определения химического состава веществ и материалов. Метод - это достаточно универсальный и теоретически обоснованный способ определения состава.
Основные требования к методам и методикам аналитической химии:
1) правильность и хорошая воспроизводимость;
2) низкий предел обнаружения — это наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью;
3) избирательность (селективность) — характеризует мешающее влияние различных факторов;
4) диапазон измеряемых содержаний (концентраций) с помощью данного метода по данной методике;
5) экспрессность;
6) простота в анализе, возможность автоматизации, экономичность определения.
Химический анализ — это сложный многостадийный процесс, представляющий собой совокупность готовых приемов и соответствующих служб.
Задачи анализ:
· Идентификация объекта, т.е. установление природы объекта (проверка присутствия тех или иных основных компонентов, примесей).
· Количественное определение содержания того или иного компонента в анализируемом объекте.
Этапы анализа любого объекта:
1. Постановка задачи и выбор метода и схемы анализа.
2. Отбор проб (грамотный отбор части пробы позволяет сделать правильный вывод о составе всей пробы).
Проба - это часть анализируемого материала, представительно отражающая его химический состав. В отдельных случаях в качестве пробы используют весь аналитический материал. Время хранения отобранных проб должно быть минимальным. Условия и способы хранения должны исключать неконтролируемые потери легколетучих соединений и любые другие физические и химические изменения в составе анализируемого образца.
3. Подготовка проб к анализу: переведение пробы в нужное состояние (раствор, пар); разделение компонентов или отделение мешающих; концентрирование компонентов;
4. Получение аналитического сигнала.
Аналитический сигнал - это изменение любого физического или физико-химического свойства определяемого компонента, функционально связанное с его содержанием (формула, таблица, график).
5. Обработка аналитического сигнала, т.е. разделение сигнала и шумов. Шумы — побочные сигналы, возникающие в измерительных приборах, усилителях и других аппаратах.
6. Применение результатов анализа.
В зависимости от свойства вещества, положенного в основу определения метода анализа подразделяются на:
· Химические методы анализа основаны на химической аналитической реакции, которая сопровождается ярко выраженным эффектом. К ним относится гравиметрический и титриметрический методы.
· Физико-химические методы основаны измерение каких-либо физических параметров химической системы, зависящих от природы компонентов системы и изменяющихся в процессе химической реакции (например: фотометрия - основана на изменении оптической плотности раствора в результате реакции).
· Физические методы анализа не связаны с использованием химических реакций. Состав веществ устанавливается по измерению характерных физических свойств объекта (например: плотность, вязкость).
В зависимости от измеряемой величины все методы делятся:
| Измеряемая физическая величина | Название метода |
| Масса | Гравиметрия |
| Объем | Титриметрия |
| Равновесный потенциал электрода | Потенциалометрия |
| Поляризационное сопротивление электрода | Полярография |
| Количество электричества | Кулонометрия |
| Электропроводность раствора | Кондуктометрия |
| Поглощение фотонов | Фотометрия |
| Испускание фотонов | Эмиссионный спектральный анализ |
Идентификация веществ основывается на методах качественного распознавания элементарных объектов (атомов, молекул, ионов и др.), из которых состоят вещества и материалы.
Очень часто анализируемую пробу вещества переводят в форму, удобную для анализа, путем растворения в подходящем растворителе (обычно это вода или водные растворы кислот) или сплавлением с каким-либо химическим соединением с последующим растворением.
Химические методы качественного анализа основаны на использовании реакций идентифицируемых ионов с определенными веществами – аналитическими реагентами. Такие реакции должны сопровождаться выпадением или растворением осадка; возникновением, изменением или исчезновением окраски раствора; выделением газа с характерным запахом; образованием кристаллов определенной формы.
Реакции, протекающие в растворах, по способу выполнения классифицируются на пробирочные, микрокристаллоскопические и капельные. Микрокристаллоскопические реакции проводят на предметном стекле. Наблюдают образование кристаллов характерной формы. Капельные реакции выполняются на фильтровальной бумаге.
Аналитические реакции, применяемые в качественном анализе, по области применения делятся на:
1)групповые реакции — это реакции для осаждения целой группы ионов (применяется один реагент, который называется групповым);
2) характерные реакции:
а) селективные (избирательные) — дают одинаковые или сходные аналитические реакции с ограниченным числом ионов (2- 5 шт.);
б) специфичные (высокоселективные) — избирательны по отношению к одному компоненту.
Селективных и специфичных реакций немного, поэтому их применяют в сочетании с групповыми реакциями и со специальными приемами для устранения мешающего влияния компонентов, присутствующих в системе наряду с определяемым веществом.
Несложные смеси ионов анализируют дробным методом, т.е. без предварительного отделения мешающих ионов с помощью характерных реакций определяют отдельные ионы. Мешающий ион – это ион, который в условиях обнаружения искомого дает сходный аналитический эффект с тем же реактивом, либо аналитический эффект, маскирующий нужную реакцию. Обнаружение разных ионов в дробном анализе проводят в отдельных порциях раствора. При необходимости устранения мешающих ионов пользуются следующими способами отделения и маскировки:
1. Перевод мешающих ионов в осадок. В основе лежит различие в величине произведения растворимости получающихся осадков. При этом ПР соединения определяемого иона с реагентом должно быть больше, чем ПР соединения мешающего иона.
2. Связывание мешающих ионов в прочное комплексное соединение. Получаемый комплекс должен обладать необходимой устойчивостью, чтобы осуществить полное связывание мешающего иона, а искомый ион – совсем не реагировать с вводимым реагентом, либо его комплекс должен быть непрочным.
3. Изменение степени окисления мешающих ионов.
4. Использование экстракции. Метод основан на извлечении из водных растворов мешающих ионов органическими растворителями и разделении системы на составные части (фазы), чтобы мешающий и определяемый компонент были в разных фазах.
Преимущества дробного анализа:
- быстрота выполнения, т.к. сокращается время на длительные операции последовательного отделения одних ионов от других;
- дробные реакции легко воспроизводимы, т.е. их можно повторять несколько раз.
Однако в случае трудности подбора: селективных (специфических) реакций обнаружения ионов; маскирующих реагентов; расчета полноты удаления ионов и других причин (сложность смеси) прибегают к выполнению систематического анализа.
Систематический анализ — это полный (подробный) анализ исследуемого объекта, который проводится путем разделения всех компонентов в пробе на несколько групп в определенной последовательности. Деление на группы идет на основе сходства (внутри группы) и различия (между группами) аналитических свойств компонентов. В выделенной группе анализа применяется ряд последовательных реакций разделения, пока в одной фазе останутся лишь компоненты, дающие характерные реакции с селективными реагентами.
Разработано несколько аналитических классификаций катионов и анионов на аналитические группы, в основе которых лежит применение групповых реагентов (т.е. реагентов для выделения в конкретных условиях целой группы ионов). Групповые реагенты в анализе катионов служат как для обнаружения и разделения, а в анализе анионов – только для обнаружения.
Схема деления на группы:
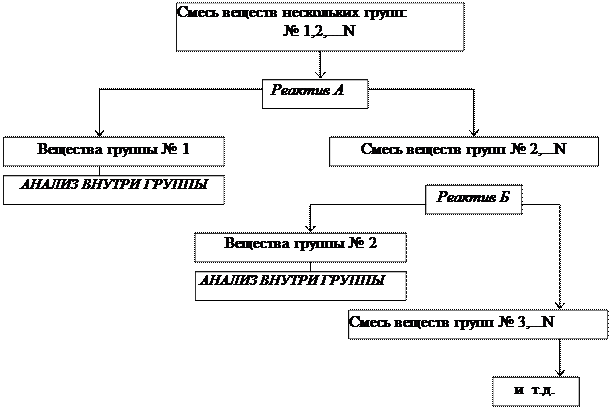
Схема анализа группы:
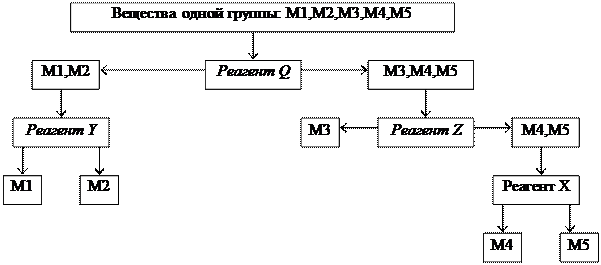 |
Анализ смесей катионов
Групповыми реагентами в качественном анализе катионов являются кислоты, сильные основания, аммиак, карбонаты, фосфаты, сульфаты щелочных металлов, окислители и восстановители. Объединение веществ в аналитические группы основано на использовании сходства и различий в их химических свойствах.
К наиболее важным аналитическим свойствам относятся способность элемента образовывать различные типы ионов, цвет и растворимость соединений, способность вступать в те или иные реакции.
Групповые реагенты выбирают из общих реактивов, поскольку необходимо, чтобы групповой реагент выделял относительно большое число ионов. Основной способ разделения – осаждение, т.е. деление на группы, основано на различной растворимости осадков катионов в определенных средах. При рассмотрении действия групповых реагентов можно выделить следующие группы:
Таблица 1
| Группа | Катионы |
| Сульфатная | Ba2+, Sr2+, Ca2+ |
| Хлоридная | Ag+, Pb2+, Hg2+ |
| Тиосолей | Sn2+, Sn(IV), Sb3+, Sb(V), Hg2+ |
| Гидроксидная | Sn2+, Sn(IV), Pb2+, Sb3+, Sb(V), Cr3+, Al3+, Zn2+ |
| Аммиачная | Co2+, Ni2+, Cu2+, Ag+, Zn2+, Cd2+ |
Кроме того, остаются три катиона (Na+, K+, NH4+) не образующие осадков с указанными групповыми реагентами. Их также можно выделить в отдельную группу.
Помимо указанного общего подхода, при выборе групповых реагентов исходят из значений произведений растворимости осадков, т.к. варьируя условия осаждения, можно разделить вещества из группы действием одного и того же реагента.
Наибольшее распространение получила кислотно-основная классификация катионов. Достоинства кислотно-основного метода систематического анализа: а) используются основные свойства элементов – их отношение к кислотам, щелочам; б) аналитические группы катионов в большей степени соответствуют группам периодической системы элементов Д.И. Менделеева; в) значительно сокращается время проведения анализа по сравнению с сероводородным методом.
Исследование начинают с предварительных испытаний, в которых устанавливают рН раствора по универсальному индикатору и обнаруживают ионы NH4+, Fe3+, Fe2+ специфическими и селективными реакциями.
Разделение на группы. Общая схема на группы дана в табл.2. В анализируемом растворе прежде всего отделяют катионы I и II групп. Для этого 10-15 капель раствора помещают в пробирку и добавляют по каплям смесь 2М HCl и 1М H2SO4. Оставляют осадок на 10 мин, затем его центрифугируют и промывают водой, подкисленной HCl. В осадке смесь хлоридов и сульфатов Ag+, Pb2+, Ba2+, Ca2+. Возможно и присутствие основных солей сурьмы. В растворе катионы III-VI групп.
Из раствора отделяют III группу прибавлением нескольких капель 3%-го H2O2 и избытка NaOH при нагревании и перемешивании. Избыток пероксида водорода удаляют кипячением. В осадке - гидроксиды катионов IV-V групп, в растворе – катионы III и VI групп и частично Ca2+, который может неполностью осадиться в виде CaSO4 при отделении I и II групп.
Из осадка отделяют катионы V группы. Осадок обрабатывают 2н Na2CO3 и затем избытком NH3 при нагревании. Катионы V группы переходят в раствор в виде аммиакатов, в осадке – карбонаты и основные соли катионов IV группы.
Таблица 4
Дата добавления: 2016-12-26; просмотров: 4114;
