Грунты как дисперсные системы
Дисперсными называются системы, состоящие из двух или более веществ, распределенных друг в друге. Газовые смеси или растворы представляют собой однофазные системы, т.к. в них мы не можем обнаружить поверхность раздела между компонентами.
В суспензии, эмульсии, дыме нужно различать поверхность отдельных частиц, распределенных в их среде. Так, в суспензии твердые частицы распределены в жидкой среде, в эмульсии частицы одной жидкости распределены в другой, в тумане частицы жидкости распределены в воздухе, в дыме частицы твердого вещества распределены в газообразном. Такие системы, в зависимости от количества компонентов, могут быть двухфазными или трехфазными. Частицы измельченного вещества называются дисперсной фазой, а вмещающие вещество – дисперсной средой.
Грунты, состоящие из измельченных твердых частиц минералов, могут представлять собой двухфазную систему типа твердые частицы + вода, твердые частицы + воздух или трехфазную систему типа твердые частицы + вода + воздух.
Изучение вопросов о грунтах как дисперсных системах имеет важное значение для понимания происходящих в них явлений и отыскания способов искусственного улучшения их природных свойств.
Между дисперсной фазой и дисперсной средой существует постоянное и непрерывное взаимодействие.
Изучением явлений, происходящих на границах сред, составляющих грунты, занимается специальная наука – грунтоведение, опирающаяся в значительной мере на основные положения коллоидной химии. Наиболее важной характеристикой многофазной системы является степень дисперсности, т.е. степень раздробленности дисперсной фазы. Высший предел дисперсности грунтов – молекулярное раздробление. Чаще мы имеем дело с частицами, раздробленными до состояния коллоидов.
Коллоиды – это не вещества, а состояние веществ по степени раздробленности. К коллоидам мы относим глинистые частицы крупностью менее 0,1 мкм, обладающие рядом специфических свойств. Не все вещества, раздробленные до крупности менее 0,1 мкм, обладают свойствами коллоидов, но глинистые минералы при раздроблении и во взаимодействии с водой, представляющей собой дисперсную среду, образуют коллоидные системы.
Системы с частицами от 0,1 до 5 мкм тоже обладают некоторыми свойствами коллоидных систем (явления коагуляции, тепловое броуновское движение и др.). Частицы крупнее 5 мкм (0,005 мм) образуют грубодисперсные системы, не обладающие коллоидными свойствами. Грунты могут представлять собой грубодисперсные системы, но могут содержать и тонкодисперсные и коллоидные системы, состоящие из твердых частиц, воды, а иногда и воздуха.
Степень дисперсности грунтов зависит от условий образования их минералогического состава. Чем тоньше измельчено вещество, тем выше его суммарная поверхность, а следовательно, тем значительнее развиты явления взаимодействия на поверхностях раздела твердой, жидкой и газообразной фаз.
Например, частицы глинистого минерала каолина имеют удельную поверхность 10 м2/г, а монтмориллониты – 800 м2/г, т.е. огромную поверхность в сотни квадратных метров в одном грамме грунта, что несомненно сказывается на свойствах природных грунтов, содержащих такие минералы.
Рассмотрим здесь те свойства коллоидов, которые имеют непосредственное отношение к вопросам природного или искусственного изменения свойств грунтов.
Коагуляция коллоидов и тонких дисперсий связана с переходом из золей (состояние вязкой жидкости) в гели (студиеобразные осадки). Коллоидные системы в грунтах обычно находятся в состоянии геля. Процессы перехода золя в гель протекают под влиянием внешних усилий (высушивание, охлаждение, изменение концентрации солей, растворенных в воде); эти процессы могут быть обратимы и необратимы. При коагуляции коллоиды слипаются друг с другом и могут склеивать более крупные частицы грунта, образуя агрегаты.
Гидрофильность, т.е. свойство связывать и удерживать некоторое количество воды, присуща как коллиодным системам, так и некоторым тонким дисперсиям. Системы, не вступающие во взаимодействие с водой, называются гидрофобными. Грунтовые коллоиды, в основном, гидрофильны и обратимы. На поверхности фаз коллоидных систем возникает электромолекулярное поверхностное натяжение, поэтому дисперсные системы обладают значительным запасом свободной энергии:
Q = aS,
где a– поверхностное натяжение на единицу поверхности, кг/см2;
S – поверхность раздела фаз, см2.
Чем больше поверхность раздела S, т.е. чем тоньше частицы, слагающие грунт, тем больше энергия. Затраты этой энергии (например, на коагуляцию) приводят к уменьшению поверхности раздела сред S.
Величина поверхностного натяжения a зависит от свойств дисперсной среды (в частности, от степени минерализации воды).
Электрические свойства коллоидов объясняются тем, что коллоидные частицы представляют собой сложные электрические системы, состоящие из заряженного ядра, неподвижного двойного слоя ионов вокруг ядра и подвижного (диффузного) слоя ионов. Образование этих слоев объясняется взаимодействием вещества дисперсной фазы с веществом дисперсной среды. Ионные оболочки не дают коллоидам слипаться и коагулировать. Коллоидные системы черезвычайно чувствительны к электролитам (ионизированным растворам), которые могут менять толщину и плотность диффузного слоя. В грунтах электролитом является минерализованная вода в порах грунта, молекулы которой образуют вокруг ионов диффузного слоя гидратные оболочки. Молекулы воды в гидратных оболочках, ориентированные радиально по отношению к ядру, образуют вокруг коллоидной частицы пленку связанной воды, обладающей особыми свойствами – повышенной плотностью, вязкостью, пониженной температурой замерзания. Гидратация диффузных слоев происходит под влиянием изменения температуры, концентрации и состава электролита и перемещения воды в грунте.
Поглотительная способность коллоидов объясняется высокоразвитой поверхностью, которая может поглощать и удерживать (адсорбировать) различные взвешенные и растворенные вещества из соприкасающейся с ней жидкости.
Адсорбция молекул воды приводит к образованию гидроскопических водных пленок вокруг частиц. Адсорбция некоторых жиров и масел придает грунтам свойство гидрофобности.
Обменное поглощение проявляется в способности коллоидов поглощать ионы из раствора, выделяя взамен ионы из адсорбционных пленок. В обменном поглощении существует строго определенная закономерность. Относительная способность того или иного иона вытеснять адсорбированные ионы из адсорбированных пленок называется энергией поглощения. По энергии поглощения катионы могут быть расположены в следующем порядке:
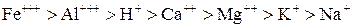 .
.
Как видно, энергия поглощения возрастает с увеличением валентности элементов; исключение составляет лишь водород, активность которого выше, чем 2-валентных катионов.
Электрические свойства коллоидов обнаруживаются в явлениях электроосмоса и электрофореза.
Электроосмос представляет собой перемещение под влиянием наложения электрического поля дисперсной среды к электроду, заряженному одноименно с коллоидными частицами.
Электрофорез – перемещение при тех же условиях дисперсной фазы (т.е. самих коллоидных частиц) к противоположно заряженному электроду.
Свойства, придаваемые грунтам коллоидами, используются в строительных целях. Коагуляция способствует образованию агрегатов, в состав которых могут входить и более крупные грунтовые частицы, т.е. структурообразованию грунта с соответствующими механическими свойствами. Способность к обменному поглощению может снизить набухаемость грунтов, их водоудерживающую способность. Явления электроосмоса и электрофореза используются для искусственного осушения и электрозакрепления грунтов.
Дата добавления: 2016-05-11; просмотров: 2459;
