Вкусовые добавки. Антиоксиданты
- Уксусная кислота и ее соли – ацетаты (K-, Na-, Ca) – Е260-Е263.
- Молочная кислота е ее соли – лактаты (K-, Na-, Ca) – Е270; Е325-Е327.
- Лимонная кислота и ее соли – цитраты – Е330-Е333.
- Винная кислота и ее соли – тартраты – Е334-Е337.
- Ортофосфаты – Е338-Е341.
- Яблочная кислота и ее соли – малаты – Е350-Е352.
- Фумаровая кислота – Е297.
- Янтарная кислота и ее соли – Е363.
- Угольная кислота – карбонаты и ее соли – Е500-Е501.
- Серная кислота и ее соли – сульфаты – Е513-Е515.
- Глюконовая кислота – Е574.
К числу антиоксидантов относятся:
- галаты (Е310-Е312), в т.ч. ароматические вещества;
- буталгидроокситолуол (ВНТ) (Е320);
- L-аскорбиновая кислота (Е300) и ее соли (аскорбаты) (Е301 – аскорбат натрия и Н302 – аскорбат кальция).
ВНТ является канцерогеном, он индуцирует жизненно важные энзимы.
Разрушение витамина Е под влиянием антиоксидантов вызывает еще большее снижение стабилизирующего эффекта относительно жирных кислот, что в конечном итоге нарушает обменные процессы в организме.
К эмульгаторам относят: лецитин (Е322); пищевую кислоту (Е470); моно-, диглицериды (Е471). Токсикологическая оценка этих веществ проблематична.
Консерванты
Консервирующий эффект заключается в торможении развития микроорганизмов, вызывающих порчу продуктов. К примеру, при изготовлении сгущенного молока его свертывание предотвращают добавкой гидрокарбоната натрия, динатрийфосфата и тринатрийцитрата. Эти стабилизирующие продукты препятствуют бактериальным процессам свертывания молока, однако «возраст» молока после введения консервантов с трудом удается восстановить.
Распространенным консервирующим агентом служит сложный эфир n-гидроксибензойной кислоты. Чаще всего применяют метиловый и пропиловый эфиры, которые обладают бактерицидными и фунгицидными свойствами. Продукты питания должны содержать не более 0,1% эфира. Консерванты, обладающие благодаря наличию фенольной группы высоким консервирующим эффектом, оказывают и определенное побочное физиологическое действие на человека. Отмечаются дурманящее (анестезирующее) локальное действие, расширение сосудов, появление судорог.
Более сильные последствия вызывает сернистая кислота, точнее ее соли, выделяющие сернистую кислоту. Эту кислоту используют для придания устойчивости винам, ее добавка в количестве до 20 мг/л уже препятствует образованию плесени. При концентрации ее более 40 мг/л она может вызвать головную боль. Большие количества сернистой кислоты можно встретить в молодых, не созревших винах (типа божоле). Запрещено повышать стойкость мяса и рыбы с помощью сернистой кислоты, устраняющей гнилостный запах мяса, даже если начался микробиологический процесс его разложения.
Для сохранения продуктов используют их окуривание с помощью пропиленоксида, который с небольшими количествами соляной кислоты образует хлорпропанол, оказывающий на некоторые виды бактерий мутагенное действие.
В качестве консервантов используют следующие вещества:
- сорбиновую кислоту и ее соли (Е200-Е203) – эти вещества нарушают энзиматический аппарат (энолазу, лактатдегидрогеназу), образование лимонной кислоты, блокируют каталазу и пероксидазу, нарушают клеточные мембраны;
- бензойную кислоту и ее соли (Е210-Е213) – влияют на рост микроорганизмов посредством уплотнения клеточных мембран, а также блокировки обмена веществ, в частности, образования лимонной кислоты и окислительного фосфорилирования;
- гидроксилбензойную кислоту – Ester – оказывает антисептическое действие аналогично фенолу. Эту кислоту называют еще «карболовой водой» из-за содержания фенола (2%). Повреждает цитоплазматическую мембрану и вызывает денатурацию белков;
- муравьиную кислоту и ее соли (Е236-Е238) – нарушают ферментные системы, особенно каталазу;
- пропионовую кислоту и ее соли (Е280-Е283) – накапливаются в межклеточных пространствах и блокируют обмен веществ; выступают как конкуренты аланина и других аминокислот. Действие зависит от реакции среды. Оптимальным является рН ниже 4,5;
- бифенил (Е230), ортофенилфенол (Е231, Е232), тиабендазол (Е233). Вещества накапливаются в межклеточных пространствах и нарушают работу цитоплазматических мембран. Ортофенилфенол является мутагеном;
- K-Na – нитраты и нитриты (Е249-Е252) – вызывают ряд заболеваний;
- SO2, SO3 (Е221-Е224), (Е226-Е228). Обладают антимикробным действием. Механизм действия заключается в замедлении (приостановлении) образования энзимов сульфгидрильной группой SH при взаимодействии с SO2 или SO3. В кислой среде и при повышенных концентрациях SO2 или SO3 может наступать инактивация тиамина, кроме того, имеет место реакция с нуклеиновыми кислотами. Это объясняет мутагенный эффект сернистого газа in vitro-системах в кислой среде. Нарушают образование витаминов и коэнзимов.
ЛАБОРАТОРНАЯ РАБОТА
«Определение сернистой кислоты в кондитерских изделиях»
Оборудование и реактивы: мерная колба вместимостью 200– 250 мл; коническая колба вместимостью 200–250 мл; пипетки; бюретка; раствор гидроксида натрия или калия 1 М; раствор серной кислоты (1:3); раствор крахмала; раствор йода 0,01 моль/л; исследуемое кондитерское изделие; дистиллированная вода.
Ход работы
1. 20 г измельченного исследуемого продукта переносят в
мерную колбу, доливают в нее дистиллированную воду до половины
объема. Колбу закрывают пробкой и часто взбалтывают в течение 10 мин.
2. Затем содержимое колбы доводят дистиллированной водой до
метки, перемешивают и дают выстояться до появления прозрачного
отстоя в суспензии. Полученный раствор фильтруют в сухую колбу.
3. В коническую колбу вносят 50 мл фильтрата и 25 мл раствора гидроксида натрия или калия, колбу закрывают, смесь взбалтывают и оставляют стоять 15 мин. Затем в колбу прибавляют 10 мл раствора серной кислоты и 1 мл раствора крахмала.
4. Содержимое колбы титруют раствором йода до появления синего окрашивания, не исчезающего при перемешивании.
5. Параллельно проводят контрольный опыт с дистиллированной водой.
6. Массовую долю общей сернистой кислоты (X) в % вычисляют по формуле (6)
X = 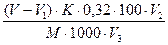 , (6)
, (6)
где V – объем раствора йода, израсходованный на титрование исследуемого раствора, см3; V1 – объем, израсходованный на контрольное титрование, см3; К – поправочный коэффициент раствора йода; 0,32 – количество миллиграммов SO2, соответствующее 1 мл 0,01 моль/л раствора йода; V2 – вместимость мерной колбы, мл; V3 – объем фильтрата, взятый для титрования, см3; М – масса исследуемого продукта, г; 1000 – пересчет граммов в миллиграммы.
7. Сделайте выводы.
ЛАБОРАТОРНАЯ РАБОТА
«Определение натрия хлорида в кормах аргенометрическим методом (метод Мора)»
Принцип метода основан на извлечении натрия хлорида из корма или патматериала дистиллированной водой с последующим титрованием иона хлора раствором нитрата серебра в присутствии хромата калия как индикатора. После связывания иона хлора серебром избыток нитрата серебра реагирует с хроматом калия, образуя хромат серебра красно-кирпичного цвета.
Приборы и реактивы: исследуемый корм или патматериал; 10%-й раствор хромата калия; 0,1 н раствор нитрата серебра; муфельная печь; водяная баня; термометр; мерные колбы и стаканы на 100 мл; тигли для сухого озоления; бумажный фильтр; бюретка для титрования.
Ход анализа
1. 10 г измельченного корма или патматериала (слизистой оболочки желудка или печени) помещают в мерную колбу на 100 мл, заливают до ¾ объема водой, хорошо встряхивают и нагревают на водяной бане до 800С.
2. Через 30 минут охлаждают до комнатной температуры, периодически встряхивая, доводят водой до метки, встряхивают и фильтруют через складчатый бумажный фильтр в сухой стакан. Если вытяжка окрашена интенсивно, можно взятую навеску подсушить на водяной бане, затем в тигле обуглить до легкораспадающейся золы, количественно перенести в мерную колбу на 100 мл и поступать далее, как описано выше.
3. 20 мл фильтрата переносят в коническую колбу, приливают 1 мл 10%-го раствора калия хромата и титруют 0,1 н раствором нитрата серебра до появления неисчезающего кирпично-красного окрашивания.
4. Содержание натрия хлорида рассчитывают по формуле (7)
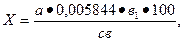 (7)
(7)
где Х – содержание натрия хлорида, %; а – количество раствора нитрата серебра, пошедшее на титрование, мл; в – объем вытяжки, взятый для титрования, мл; в1 – общий объем вытяжки, мл; 0,005844 – количество NaCl (г), связывающегося 1 мл 0,1 н раствора AgNO3.
5. Данные оформляют в виде таблицы и делают вывод из проделанной работы о наличии хлорида натрия в исследованном образце.
Дата добавления: 2016-09-20; просмотров: 735;
