АМОРФНЫЕ ТВЕРДЫЕ ТЕЛА.
Аморфные твердые тела по многим своим свойствам и главным образом по микроструктуре следует рассматривать как сильно переохлажденные жидкости с очень высоким коэффициентом вязкости. С энергетической точки зрения различие между кристаллическими и аморфными твердыми телами хорошо прослеживаются в процессе отвердевания и плавления. Кристаллические тела имеют точку плавления – температуру, когда вещество устойчиво существует в двух фазах – твердой и жидкой (рис1). Переход молекулы твердого тела в жидкость означает, что она приобретает дополнительно три степени свободы поступательного движения. Т.о. единица массы вещества при Тпл. в жидкой фазе имеет большую внутреннюю энергию, чем такая же масса в твердой фазе. Кроме того, меняется расстояние между частицами. Поэтому в целом количество теплоты необходимое для превращения единицы массы кристалла в жидкость будет:
λ = ( Uж-Uk ) + P ( Vж-Vk ),
где λ – удельная теплота плавления (кристаллизации), (Uж-Uk) – разность внутренних энергий жидкой и кристаллической фаз, Р – внешнее давление, (Vж-Vk) – разность удельных объемов. Согласно уравнению Клайперона - Клаузиуса температура плавления зависит от давления:
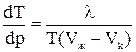 .
.
Видно, что если (Vж-Vk)> 0, то 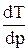 > 0, т.е. с ростом давления температура плавления повышается. Если же объем вещества при плавлении уменьшается (Vж-Vk)< 0 (вода, висмут), то рост давления приводит к понижению Тпл.
> 0, т.е. с ростом давления температура плавления повышается. Если же объем вещества при плавлении уменьшается (Vж-Vk)< 0 (вода, висмут), то рост давления приводит к понижению Тпл.
У аморфных тел теплота плавления отсутствует. Нагревание приводит к постепенному увеличению скорости теплового движения и уменьшению вязкости. На графике процесса имеется точка перегиба, которую условно называют температурой размягчения.
Фазовые переходы. Диаграммы состояния. Тройная точка.
Фазой называется термодинамическое равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Переход вещества из одной фазы в другую – фазовый переход - всегда связан с качественными изменениями свойств тела. Примером фазовых переходов могут служить изменения агрегатного состояния. Но понятие «фазовый переход» шире, т.к. оно включает и переход вещества из одной модификации в другую при сохранении агрегатного состояния (полиморфизм). Пример, превращение алмаза в графит. Различают два вида фазовых переходов.
Фазовый переход 1 рода – сопровождается поглощением или выделением теплоты, изменением объема и протекает при постоянной температуре. Примеры: плавление, кристаллизация, испарение, сублимация (возгонка) и др.
Фазовые переходы 2 рода – протекают без выделения или поглощения тепла, с сохранением величины объема, но скачкообразным изменением теплоемкости. Примеры: переход ферромагнитных минералов при определенных значениях давления и температуры в парамагнитное состояние (железо, никель); переход некоторых металлов и сплавов при температуре близкой к 00К в сверхпроводящее состояние ( ρ = 0 Ом∙м ) и др.
Для химически однородного вещества понятие фазы совпадает с понятием агрегатное состояние. Рассмотрим для такой системы фазовые превращения, используя для наглядности диаграмму состояния (рис2). На ней в координатах Р и Т задается зависимость между температурами фазовых переходов и давлением. Эти зависимости в виде кривых испарения (ОИ), плавления (ОП) и сублимации (ОС) и образуют диаграмму состояния.
Точка О пересечения кривых определяет условия (Т и Р), когда все три агрегатных состояний вещества находятся в термодинамическом равновесии. По этой причине она называется тройной точкой. Например, тройная точка воды является одной из реперных точек (00С) температурной шкалы Цельсия. Как следует из уравнения Клайперона – Клаузиуса характер зависимости Т = f(Р) перехода твердое тело – жидкость для веществ, которые при переходе в жидкую фазу увеличивают объем (вода, германий, чугун), рис.2а, и веществ, для которых характерно уменьшение объема, рис. 2б - разный.
Кривая испарения заканчивается критической точкой - К. Как видно из диаграммы, существует возможность непрерывного перехода жидкости в газообразную фазу без пересечения кривой испарения, т.е. без присущих такому переходу фазовых превращений.
При давлении меньшим, Р – тройной точки, вещество может существовать только в двух фазах: твердой и газообразной. Причем, при температурах, меньших Ттр.тчк., возможен переход из твердого состояния в газ минуя жидкую фазу. Такой процесс называется сублимацией или возгонкой. Удельная теплота сублимации
τсуб = λпл + rисп
Дата добавления: 2016-08-07; просмотров: 940;
