Прекращение испытания
Длительность КИ планируется исходя из числа участников и ожидаемой частоты исходов, ожидаемого различия между вмешательствами (размера эффекта) и планируемой статистической значимости результата. Можно провести относительно короткое испытание, если включить много участников. Если не запланировать длительности испытания, а просто ожидать, когда различие между сравниваемыми группами станет статистически значимым, то это будет ошибкой. Повторное применение статистических критериев для проверки значимости различий приводит к увеличению вероятности ложноположительных выводов — вероятности обнаружения значимого различия там, где его нет. Это один из вариантов ошибки, возникающей при множественных сравнениях. Проведение испытания до момента, когда его результат станет статистически значимым, будет ошибкой, которую в обыденной жизни люди не допускают: никто не согласится играть на деньги до момента, когда выигрыш у противника будет больше 1000 рублей. Поэтому длительность КИ устанавливается заранее.
В длительных испытаниях правила прекращения КИ устанавливают, поскольку это может быть необходимым для обеспечения безопасности участников и при получении убедительных результатов в пользу одного из изучаемых вмешательств. Принято думать, что после того, как преимущества одного из сравниваемых вмешательств установлены, изменяется ситуация: для участников КИ вмешательства становятся неравными, какими они были в момент начала испытания. Испытание должно быть прекращено и всем участникам предоставлена информация о результатах и доступ к найденному более эффективному вмешательству.
Статистическая оценка результатов испытания.
| Неблагоприятный исход | Всего | ||
| Наблюдался | Отсутствовал | ||
| Плацебо | А | B | A+B |
| Препарат | С | D | C+D |
Риск при лечении плацебо Pпл=А/(А+В)
Риск при лечении изучаемым препаратом Рлр=С/(С+D)
Абсолютное снижение риска АСР=А/(А+В)-С/(С+D)
Число пациентов, подвергаемых
лечению, на один предотвращенный
неблагоприятный исход ЧПЛП=1/АСР
Относительный риск ОР=[C/(C+D)]/[A/(A+B)]
Снижение относительного риска СОР=1-ОР
Изучение побочных эффектов вмешательств.
| Неблагоприятный исход | Всего | ||
| Наблюдался | Отсутствовал | ||
| Плацебо | А | B | A+B |
| Препарат | С | D | C+D |
Абсолютное повышение риска АПР= С/(С+D)-А/(А+В)
Число пациентов, подвергаемых
лечению, на один вредный исход ЧПЛВ=1/АПР
Стандарт отрасли ОСТ 42-511-99 "Правила проведения качественных клинических испытаний в Российской Федерации"
Для оценки эффективности лекарственного средства используется стандарт отрасли ОСТ 42-511-99 "Правила проведения качественных клинических испытаний в Российской Федерации" (утв. Минздравом РФ от 29 декабря 1998 г.) Дата введения 1999.01.01
Область применения
Настоящий стандарт устанавливает требования к проведению клинических испытаний лекарственных средств.
Правила проведения качественных клинических испытаний в Российской Федерации (Good Clinical Practice -GCP) представляют собой этический и научный стандарт качества планирования и проведения исследований на человеке, а также документального оформления и представления их результатов. Соблюдение этих правил служит гарантией достоверности результатов клинических испытаний, безопасности, охраны прав и здоровья испытуемых в соответствии с основополагающими принципами Хельсинкской декларации.
Требования данных Правил должны соблюдаться при проведении клинических испытаний лекарственных средств, результаты которых планируется представить в разрешительные инстанции.
Принципы качественных клинических испытаний (GCP)
- Клинические испытания должны проводиться в соответствии с основополагающими этическими принципами Хельсинкской Декларации, Правилами GCP и действующими нормативными требованиями.
- До начала клинического испытания должна быть проведена оценка соотношения предвидимого риска с ожидаемой пользой для испытуемого и общества. Клиническое испытание может быть начато и продолжено только в случае преобладания ожидаемой пользы над риском.
- Права, безопасность и здоровье испытуемого важнее интересов науки и общества.
- Обоснованием планируемого клинического испытания должны служить данные доклинического и клинического изучения исследуемого препарата.
- Клиническое испытание должно быть научно обосновано, подробно и ясно описано в протоколе исследования.
- Клиническое испытание проводится в соответствии с протоколом, заблаговременно утвержденным/одобренным Экспертным Советом/Комитетом по этике.
- Ответственность за оказание медицинской помощи испытуемому может взять на себя только квалифицированный врач.
- Все лица, участвующие в проведении клинического испытания, должны иметь профессиональное образование и опыт, соответствующий поставленным задачам.
- Испытуемый может быть включен в испытание только на основании добровольного информированного согласия, полученного после детального ознакомления с материалами исследования.
- Сбор, обработка и хранение информации, полученной в ходе клинического испытания, должны обеспечивать точное и правильное представление, объяснение и подтверждение данных.
- Документы, позволяющие установить личность испытуемого, должны сохраняться в тайне от неуполномоченных лиц.
- Производство и хранение исследуемого препарата, а также обращение с ним осуществляется в соответствии с Правилами организации производства и контроля качества лекарственных средств (Good Manufacturing Practice -GMP). Препарат должен использоваться в соответствии с утвержденным протоколом исследования.
Основные документы необходимые для проведения РКИ:
- протокол исследования и поправки к нему;
- форма письменного информированного согласия и ее последующие редакции;
- материалы для привлечения испытуемых к участию в исследовании (например,
рекламные объявления);
- Брошюра исследователя;
- имеющаяся информацию по безопасности исследуемого препарата;
- информация о выплатах и компенсациях испытуемым;
- curriculum vitae исследователя на настоящий момент и/или другие материалы,
подтверждающие его квалификацию;
- любые другие документы, которые могут потребоваться Экспертному совету/Комитету по этике для исполнения своих обязанностей.
Этические аспекты проведения РКИ:
Согласно Указанию Минздрава РФ от 19 августа 1999 г. N 891-У функции Комитета по этике при Федеральном органе контроля качества, эффективности и безопасности лекарственных средств возложены на Национальный этический комитет. Основная задача Экспертного совета/Комитета по этике – защита прав и здоровья испытуемых, а также гарантия их безопасности. Особое внимание уделяется тем исследованиям, участниками которых могут быть уязвимые испытуемые.
Задача 1.
Пациенты с тяжелым хроническим зудом участвовали в испытании лекарственных препаратов, купирующих зуд. В течение каждой из трех недель в случайной последовательности 48 пациентов получали либо ципрогептадина хлорид, либо тримепразидина тартрат, либо плацебо. Кроме того, в график приема препаратов и плацебо был введен (также в случайном порядке) однонедельный перерыв. Результаты оценивались в отсутствие сведений о принимаемом препарате и представлялись в баллах выраженности зуда: чем выше балл, тем сильнее зуд. Полученные средние значения были следующими: ципрогептадина хлорид – 28 баллов, тримепразидина тартрат – 35 баллов, плацебо – 30 баллов, отсутствие лечения – 50 баллов.
Задание:
1. Сделайте предварительный вывод об эффективности каждого вмешательства.
2. Укажите причины повлиявшие на результат.
Задача 2.
1 – преимущественно специфическое действие;
2 – смешанное действие;
3 – преимущественно неспецифическое действие
А – наркотические средства, антидепрессанты;
Б – средства против зуда, инъекции в триггерные точки;
В – антимикробные средства, антиметаболиты.
Задание:
Установите соответствие.
Задача 3.
При проведении клинического испытания нового антибиотика была произведена выборка больных пневмонией легкой формы течения. Случайным образом были сформированы четыре группы пациентов. В первой группе вмешательство не проводилось, за пациентами второй группы было установлено наблюдение, в третьей группе пациенты получали плацебо, в четвертой – исследуемый препарат. Через неделю была проведена оценка эффективности лечения. Критерием эффективности считалось клиническое улучшение состояния. В первой группе улучшение состояния наблюдалось у 15 % пациентов, во второй – у 23%, в третьей – у 35 %, в четвертой – у 85 %.
Задание:
1. Оцените полученные результаты.
2. Укажите причины, повлиявшие на полученные результаты.
 Задача 4.
Задача 4.
 | |||
 | |||
Задание:
Оцените вклад различных причин в суммарный лечебный эффект и дайте объяснение полученных результатов.
Задача 5.
При проведении клинического испытания двух лекарственных препаратов пациенты делились на группы разными способами. В первом случае пациентов делили по четности номера карты (четные номера – основная группа, нечетные – контрольная), во втором случае по дню недели поступления в стационар (понедельник, среда, пятница, воскресенье – основная, вторник, четверг, суббота – контрольная).
Задание:
1. Оцените правильность организации первого и второго исследования.
2. Дайте рекомендации по проведению рандомизации.
Задача 6.
В крупном исследовании влияния нескольких гиполипидемических препаратов на развитие стенокардии 1103 мужчинам был назначен клофибрат и 2789 мужчинам - плацебо. Летальность за последние 5 лет составляла в среднем 20,0% в группе принимавших клофибрат и 20,9% в группе принимавших плацебо, что указывает на неэффективность препарата.
В то же время было обнаружено, что не все пациенты принимали лекарство. Был ли клофибрат эффективен у тех, кто действительно принимал препарат? Ответ оказался утвердительным. В экспериментальной группе летальность за последние 5 лет среди пациентов, действительно принимавших клофибрат, составила 11,0% по сравнению с 26,4% у пациентов, не соблюдавших схему лечения (р< 10-5). Летальность среди больных, которые строго выполняли назначения и принимали плацебо также снизилась. В данном случае летальность за последние 5 лет у пациентов действительно принимавших препарат составила 19,3% против 25,3% среди тех, кто не принимал его (р<10-15).
Задание:
1. Оцените полученные результаты.
2. Укажите причины, повлиявшие на результаты.
3. Сделайте предварительный вывод об эффективности препарата.
Задача 7.
Лечение больных СПИДом связано с эмоциями, в частности потому, что болезнь поражает молодых людей и неизбежно заканчивается смертью в течение нескольких лет после появления симптомов. Изучению эффективности методов лечения препятствует нарушение обычных процедур рандомизированных испытаний, поскольку пациенты пытаются увеличить свои шансы на выживание. В ходе рандомизированных испытаний пациенты иногда обмениваются препаратами или получают через "лекарственные клубы" препараты, не используемые в испытании. О таких поступках они не сообщают исследователям, так что эти факторы невозможно учесть при подведении итогов испытания.
Задание:
Определите каким образом такое вмешательство в исследование оказывает влияние на получаемые результаты.
Задача 8.
Оцените правильность организации исследований в следующих случаях. Укажите, каким образом такая организация исследования могла повлиять на полученные результаты.
1. В клиническом испытании нового препарата для снижения уровня триглицеридов крови пациенты были поделены на две группы. Пациенты первой группы получали препарат, во второй группе – плацебо. Пациенты знали свою принадлежность к группе.
2. В клиническом испытании антибиотика у пациентов с пневмонией результат оценивался по изменению рентгенологической картины. Врач, проводивший испытание знал принадлежность пациентов к контрольной или основной группе. При этом улучшение рентгенологической картины врач выявлял раньше у пациентов экспериментальной группы.
3. Было проведено клиническое испытание нового дорогостоящего препарата класса статинов. Статистик, оценивающий результаты знал принадлежность пациентов к контрольной или основной группе. По совместительству статистик работал в фармацевтической компании, заказавшей это исследование.
Задача 9.
В исследовании первичной профилактики сердечнососудистых заболеваний было использовано практически идеальное плацебо. Одни участники получали холестирамин (экспериментальная группа), другие - порошок такого же вида, вкуса и запаха - плацебо (контрольная группа). Однако побочные эффекты встречались существенно чаще в экспериментальной группе. В конце первого года испытания у пациентов экспериментальной группы чаще, чем в контрольной, отмечались запоры (39% против 10%), изжога (27% против 10%), отрыжка и метеоризм (27% против 16%), а также тошнота (16% против 8%).
Задание:
Оцените, каким образом данная ситуация может повлиять на полученные результаты.
Задача 10.
Было проведено двойное слепое рандомизированное испытание, чтобы выяснить, предотвращает ли прием пропранолола повторный инфаркт миокарда. После окончания исследования, но до раскрытия кодов, пациентов и медицинский персонал попросили отгадать, какой препарат принимал пациент. Среди пациентов 79,9% правильно отгадали пропранолол и 57,2% - плацебо. Врачи и медицинские сестры показали такой же результат.
Задание:
Оцените, каким образом данная ситуация может повлиять на полученные результаты
Задача 11.
1) Внутривенные инъекции.
2) Пероральная форма лекарственного средства.
3) Мануальная терапия.
4) Иглорефлексотерапия.
5) Оперативное вмешательство.
Задание:
Определите возможные трудности стандартизации и дозиметрии указанных методов. Дайте обоснование принятого решения.
Задача 12.
При проведении рандомизированного клинического испытания эффективности препарата Арбидол среди детей в возрасте от 2 до 6 лет было сформировано две группы: основная (экспериментальная) группа численностью 143 пациента и контрольная – 151 пациент. Пациенты основной группы получали Арбидол в дозе 0,05 в течение 6 дней, пациенты контрольной группы получали плацебо. Исследование продолжалось в течение 3-х месяцев, после чего проводилась оценка результатов по количеству заболевших гриппом и ОРВИ, а также количество осложненных гриппа и ОРВИ.
В опытной группе заболели 66 пациентов, при этом осложнения наблюдались у 7 пациентов, в контрольной группе заболели 95 пациентов, осложнения были у 20 пациентов.
Задание:
Оцените по представленным данным эффективность препарата Арбидол по показателям (см. Приложение) на предотвращение развития заболевания грипп и ОРВИ и на предотвращение развития осложнений.
Задача13
. 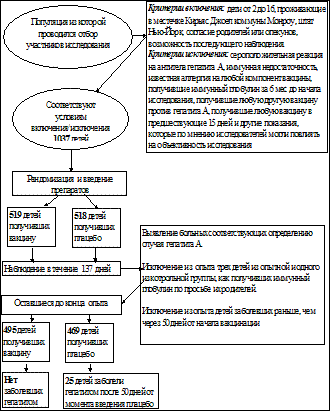
Схема составлена на основании данных, изложенных в публикации «Формалин-инактивированная вакцина гепатита А, Приложение 1. А. Верзбергер и др.Nеw England Jornal of Medicine. 327 (7), 1992)
Задание:
1. Изучите представленную схему и составьте ее заголовок.
2. Укажите, какими терминами следует обозначить дизайн данного исследования и объясните основные его этапы.
3. Определите цель этого исследования.
4. Укажите, какой или какие показатели (величины, коэффициенты) рассчитываются при такой организации исследования и расшифруйте их эпидемиологический смысл.
5. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования считать абсолютно истинными
Приложение к задаче №12.
| Неблагоприятный исход | Всего | ||
| Наблюдался | Отсутствовал | ||
| Плацебо | А | B | A+B |
| Препарат | С | D | C+D |
Риск при лечении плацебо Pпл=А/(А+В)
Риск при лечении изучаемым препаратом Рлр=С/(С+D)
Абсолютное снижение риска АСР=А/(А+В)-С/(С+D)
Число пациентов, подвергаемых
лечению, на один предотвращенный
неблагоприятный исход ЧПЛП=1/АСР
Относительный риск ОР=[C/(C+D)]/[A/(A+B)]
Снижение относительного

Диагностические и скрининговые тесты
В результате изучения темы студент должен
Уметь:
• Рассчитывать
- чувствительность и специфичность измерения
- ложноположительные и ложноотрицательные показатели
- прогностическую значимость положительного и отрицательного тестов
- претестовую вероятность и шансы
- посттестовую вероятность и шансы
- отношение правдоподобия (likehood ratio)
Сравнить значения чувствительности и специфичности для определения полезности диагностического теста.
В результате изучения темы студент должен:
Знать:
Понятия диагностического и скринингового теста.
- основную схему испытания диагностического теста.
-понятие и критерии оценки валидности и воспроизводимости теста.
- влияние чувствительности и специфичность влияет на оценку распространенности болезни
- зависимость прогностической значимости теста от распространенности болезни
- разницу между дифференцированной и недифференцированной ошибочной
классификацией
- влияние недифференцированной и дифференцированной ошибочной классификация одной или обеих переменных на оценку показателей заболеваемости в сравниваемых группах
-факторы и показатели валидности для определения полезности скринингового теста - значения показателей валидности для определения полезности диагностического теста
Работа на занятии
1 Понятия диагностического и скринингового теста.
2 Основная схема испытания диагностического теста.
3 Понятие и критерии оценки валидности и воспроизводимости диагностических скрининговых тестов.
- чувствительность и специфичность измерения
- ложноположительные и ложноотрицательные показатели
- прогностическая значимость положительного и отрицательного результата тестов
- претестовая и посттестовая вероятность и шансы
- отношение правдоподобия (likehood ratio)
Выполнение заданий:
1. Расчет показателей чувствительности и специфичности, ложноположительных и ложноотрицательных показателей. Влияние чувствительности и специфичности диагностических тестов на оценку распространенности болезни. (Задание 1)
2. Влияние тестов с разной валидностью на оценку показателей заболеваемости на в сравниваемых группах . (Задания 2 и 3).
3. Оценка критериев валидности для определения полезности скринингового теста. Факторы, влияющие на выбор скринингового теста (Задания 4 и 5).
4 Оценка критериев валидности для определения полезности диагностического теста (задание 6).
Дата добавления: 2016-08-07; просмотров: 1688;
