Технология производства неорганических кислот
Наиболее широко применяемыми неорганическими кислотами являются серная, азотная и соляная. Из них серной принадлежит особое место. По объему производства и области применения она занимает одно из первых мест среди продукции химической промышленности.
Серная кислота используется в самых разнообразных отраслях производства. Она служит одним из главных продуктов, определяющих развитие химической промышленности, вот почему ее часто называют "хлебом химии".
В химической промышленности серную кислоту используют для производства удобрений, получения красителей, пластмасс, химических волокон, при производстве нефтепродуктов — жидких топлив, смазочных масел и др. В металлургии серная кислота используется при выделении металлов из руд, в машиностроении — при травлении, в пищевой промышленности — при получении патоки, крахмала, спирта, в текстильной — при отбеливании тканей и т.д.
По химическому составу серная кислота представляет собой соединение серного ангидрид SO3 с водой. При «том если на один моль серного ангидрида приходится моль воды, то образуется безводная серная кислота Н2SО4.Если соотношение SO3 : Н2О < 1, то образуется разбавленная серная кислота, если соотношение SO3 : Н2О > 1, то — раствор серного ангидрида в серной кислоте, называемый олеумом: В промышленности серная кислота выпускается в виде разбавленной, концентрированный и олеума.
По внешнему виду серная кислота — это бесцветная маcлоподобная жидкость с удельным весом 1,84 кг/см. Исходным веществом при ее получении служит сернистый ангидрид SO2, образующийся при обжиге различных серосодержащих продуктов.
Большое значение имеет использование отходящих газов цветной металлургии, образующихся при переработке сернистых руд, в качестве исходного сырья для получения серной кислоты, что позволяет снизить се себестоимость, а утилизация их дает возможность улучшить условия труда на металлургических заводах.
Сернистый газ можно также получить из сероводорода. Последний в значительных количествах выделяется из газов нефтеперерабатывающей промышленности. Самым лучшим сырьем для производства SO2 является элементарная сера. При ее сжигании образуется чистый концентрированный сернистый газ, не загрязненный примесями, что упрощает его очистку при производстве серной кислоты. Однако чистая сера — это слишком дорогое сырье, вследствие чего себестоимость серной кислоты» получаемой и» серы, в два раза выше себестоимости Н2SО4, получаемой из колчедана FeSО2.
В настоящее время в промышленности серную кислоту получают двумя способами — нитрозным и контактным. В обоих случаях сущность процесса сводится к окислению сернистого газа SO2 до серного SO3и соединению трехокиси с водой.
В обычных условиях сернистый газ кислородом воздуха не окисляется, поэтому процесс окисления осуществляется либо при помощи азота, либо в присутствии твердого катализатора. Способ окисления и определяет технологию процесса. При нитрозном способе двуокись окисляют до SO3 при помощи нитрозной смеси, состоящей на окиси и двуокиси азота, взятых в соотношении 1:1. Контактный способ состоит в окислении двуокиси в присутствии твердого катализатора.
Более старым является нитрозный способ производства серной кислоты. Нитрозный способ трудно поддается автоматизация. Кроме того, получаемая кислота имеет концентрацию не более 75 —77% и загрязнена примесями. Эти недостатки привели к тому, что нитрозный способ производства серной кислоты все больше утрачивает свое значение, а преимущественное развитие получает контактный метод.
Технология контактного процесса предусматривает окисление сернистого газа в присутствии твердых катализаторов. До.20—30-х годов в качестве катализатора использовали платину. Затем она была заменена значительно более дешевыми устойчивым катализатором, изготавливаемым из пятиокиси ванадия Y2O5.
При контактном способе производства может быть полуученая серная кислота практически любой концентрации и высокой степени чистоты. Такая серная кислота может быть использована в любом производстве.
Нитрозная кислота, выпускаемая по устаревшей технологии, используется при производстве сельскохозяйственных удобрений, где не требуется высокой концентрации и чистоты исходных продуктов.
Азотная кислота по значению и объему производства занимает второе место после серной. Она широко применяется при производстве удобрений, взрывчатых веществ, ракетного топлива, синтетических красителей, пластмасс, нитроцеллюлозы, синтетических волокон и т.д. По внешнему виду азотная кислота представляет собой тяжелую бесцветную жидкость с удельным весом 1,52 г/см8, химический состав ее выражается формулой HNO3.
Промышленное получение азотной кислоты осуществляется окислением синтетического аммиака. Процесс осуществляется в три стадии: 1) окисление аммиака кислородом воздуха до окиси азота в присутствии катализатора (платины и ее сплавов); 2) окисление окиси азота до двуокиси; 3) поглощение NО2 водой с образованием азотной кислоты.
Окисление аммиака до окиси азота протекает с достаточной скоростью лишь при высоких температурах. При этом возможны побочные реакции, приводящие к выделению не окиси азота, а свободного азота или его закиси. Чтобы пред -отвратить эти реакции, необходимо вести окисление при температурах не, выше 700—800 °С в присутствии катализатора. Последний изготавливается в виде сеток из очень тонкой проволоки диаметром 0,06— 0,09 мм.
Данный способ производства азотной кислоты позволяет получить кислоту концентрацией -48 -т- 5,0%. Для получения более концентрированного продукта процесс ведут, при повышенном давлении. Применение давления до 10 ат позволяет повысить концентрацию азотной кислоты до 60—62%.
В настоящее время в производстве различают три технологические схемы получения азотной кислоты: I) под атмосферным давлением; 2) под давлением до 10 ат; 3) комбинированная.
Схема под давлением в принципе не отличается от схемы под атмосферным давлением, но объем окислительных и абсорбционных аппаратов значительно меньше. Процесс окисления окиси азота до двуокиси протекает намного быстрее и возрастает степень абсорбции окислов» водой, Вместе с тем при увеличении давления в процессе окисления аммиака возрастают потери дорогостоящего катализатора, что является недостатком этой схемы.
Комбинированный способ позволяет использовать достоинства обеих схем. При нем окисление аммиака осуществляется при атмосферном давлении, что резко снижает потери платины, а окисление нитрозных газов до двуокиси и абсорбация их проводятся под давлением. Это позволяет получать кислоту концентрацией 60 — 62%. На установках комбинированного способа применяют давление до 4 — 9 ат.
Концентрированную азотную кислоту, содержащую 97 — 98% HNO3, получают путем упаривания разбавленной азотной кислоты в присутствии серной кислоты, поглощающей воду. Применяется также прямой синтез концентрированной HNO3. В этом случае двуокись азота охлаждают до — 8 °С. Она при этом сжижается с образованием димера N2O4. Последний подается в аппараты, где под давлением 50 ат и температуре 75 °С в присутствии воды и кислорода образуется концентрированная азотная кислота:
2 N2O4 + 2 H2O + O2 = 4 HNO3
Масштабы производства соляной кислоты меньше по сравнению с серной и азотной. Ёе употребляют при производстве различных хлористых солей, в процессе гидролиза клетчатки, при травлении металлов, при пайке, лужении и т.д.
Соляная кислота представляет собой раствор хлористого водорода в воде. Хлористый водород НС1 — это бесцветный газ с резким запахом, хорошо растворимый в воде. В промышленности он может быть получен двумя способами: прямым синтезом из H2 и CI2 и при хлорировании органических соединений.
Наибольшее распространение в промышленности получил метод прямого синтеза хлористого водорода из газообразных хлора и водорода, получаемых при электролизе растворов поваренной соли.
Реакция между хлором и водородом CI2 + H2 = 2HCI протекает только на свету и при нагревании. Она относится к типу цепных и может привести к взрыву, если смешивать большие объемы исходных компонентов. Спокойное течение реакций обеспечивается непрерывным поступлением струи газов в зону высокой температуры (до 2400 °С). Процесс ведется в специальных печах с охлаждением воздухом иди водой.
Большое количество хлористого водорода образуется в процессе синтеза органических соединений, например, при хлорировании бензола для получения хлорбензола: C6H6 + С12 = C6H5CI + HCI.
Для характеристики эффективности процессов в химической промышленности используют ряд показателей:
• степень превращения X -— показатель, характеризующий полноту использования исходного сырья и степень его превращения в готовый продукт, которая рассчитывается по формуле:
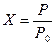 ,
,
где Р — количество взятого в процессе исходного продукта; Р0 — количество этого продукта, прореагировавшего в ходе химического процесса;
• выход продукта Ф — это отношение количества полученного вещества Р к максимально возможному Р mах рассчитанному по уравнению химической реакции:

· производительность П, т.е. количество продукта, выработанного в единицу времени:
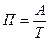 , где Л — количество выработанного продукта; Т — время работы;
, где Л — количество выработанного продукта; Т — время работы;
• интенсивность U — это производительность, отнесенная к объему или площади поперечного сечения аппарата:
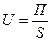 или
или 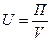
где П — производительность; S — площадь сечения аппарата; V—объем аппарата.
• себестоимость продукции: а) цеховая; б) производственная; в) полная.
Цеховая себестоимость представляет собой затраты цеха, связанные с производством продукции. Производственная себестоимость помимо затрат цехов включает общезаводские расходы. Полная себестоимость складывается из производственной себестоимости и непроизводственных расходов, включающих в основном расходы, связанные с реализацией продукции.
При расчете производственной себестоимости учитываются затраты на: 1) сырье, основные материалы, покупные изделия и полуфабрикаты; 2) вспомогательные материалы; 3) топливо; 4) энергию; 5 ) амортизацию основных фондов; 6) основную и дополнительную заработную плату; 7) отчисления на социальное страхование; 8) общезаводские расходы. Наибольшие расходы при этом, как правило, приходятся на сырье. В среднем по химической промышленности затраты на сырье составляют 60—70% себестоимости, а на топливо и энергию — около
Дата добавления: 2016-05-05; просмотров: 2548;
