Конформационная лабильность белков
Первичная структура белков. Видовая специфичность белков. Наследственные изменения первичной структуры. Полиморфизм белков. Наследственные протеинопатии: серповидно-клеточная анемия, др примеры.
Белок – это последовательность АК, связанных друг с другом пептидными связями.
Легко представить, что количество аАК может быть различно: от минимум 2х до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 до 40 АК – полипептид, если более 40 АК – белок. Объединение АК через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка. Молекулярная масса белков колеблется в пределах от 6000 до 1000000 и более. Все белки построены в основном из двадцати различных АК. АК в пептидной цепи связаны м/у собой через карбоксильную группу 1й и аминогруппу другой АК. Такая связь называется пептидной связью. Пептидная связь имеет некоторые черты двойной связи: вокруг нее нет свободного вращения, и она короче других С—N-связей. Все 4 атома пептидной связи (С, Н, N, О) и два α-углеродных атома лежат в одной плоскости. Кислород карбоксильной группы и водород NH-группы чаще всего находятся в транс-положении. Группа, связанная с α-углеродным атомом, обладает свободным вращением. Форма пептидной молекулы определяется углами между плоскостями, в которых лежат атомы пептидной связи, разделенными друг от друга —СН—R-группами, что и ведет к возникновению определенных вторичных структур. Последовательность и соотношение АК в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.
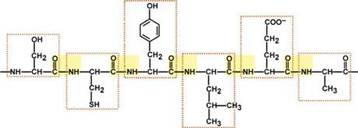 Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала)
Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала)
(пептидные связи выделены желтым цветом, АК - красной рамкой)
В организме человека насчитывают около
50 000 индивидуальных белков. Видовая и индивидуальная специфичность набора белков в данном организме определяет особенности его строения и функционирования. Набор белков в дифференцирующихся клетках одного организма определяет морфологические и функциональные особенности каждого типа клеток. Одни и те же АК присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования АК в белке. Однако многие белки, выполняя одну и ту же функцию, несколько отличаются по строению у разных представителей одного и того же вида. Примером могут служить белки групп крови у человека. Такое разнообразие белков обусловливает индивидуальную специфичность организмов.
В процессе развития многоклеточного организма, особенно на стадиях дифференцировки клеток, белковый состав значительно изменяется. При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии. Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Первичная структура белков, т.е. последовательность АК в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Если изменение последовательности аАКносит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизм белков.
При изучении структуры гемоглобина эритроцитов крови человека обнаружили, что каждая белковая молекула состоит из четырех полипептидных цепей (2 альфа и 2 бета-цепи). Установив первичную структуру белка, т. е. последовательность аминокислот в каждой цепи, выяснили также, с помощью каких связей между R-группами (радикалами аминокислот) образуется его третичная и четвертичная структура . Все здоровые люди имеют гемоглобин с одинаковой первичной и пространственной структурой. У людей, страдающих серповидноклеточной анемией - тяжелым наследственным заболеванием, эритроциты похожи не на диски, как обычно, а на серпы ( рис. 39 ). Такое изменение формы клеток происходит из-за отличия первичной структуры гемоглобина у больных людей. В беа-цепи нормального гемоглобина на шестом месте от NH2-конца стоит глутаминовая кислота. При серповидноклеточной анемии она заменена на аминокислоту валин ( рис. 40 ). Из 574 аминокислот, входящих в состав гемоглобина, заменены только две (по одной в каждой бета-цепи). Но это приводит к существенному изменению третичной и четвертичной структуры белка и, как следствие, к изменению формы и нарушению функции эритроцита. Серповидные эритроциты плохо справляются со своей задачей - переносом кислорода. Семейная гиперхолестеринемия (сокращенно СГ) - это генетическая болезнь, характеризующаяся высоким уровнем холестерина в крови, в частности, очень высоким уровнем липопротеидов низкой плотности (ЛПНП, т.н. "плохой холестерин"), а также ранним (в молодом возрасте) возникновением сердечно-сосудистых заболеваний. У многих пациентов происходят мутации в гене рецептора ЛПНП, кодирующего соответствующий белок ЛПНП-рецептора (обычно отвечающего за поглощение ЛПНП с кровотока) или аполипопротеина В (апо-В), который является частью ЛПНП, который связывается с рецептором (процесс, необходимый для связывания ЛПНП с рецептором).
2. Конформация белковых молекул (вторичная и третичная структуры). Типы внутримолекулярных связей в белках. Роль пространственной организации пептидной цепи в образовании активных центров. Конформационные изменения при функционировании белков.
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
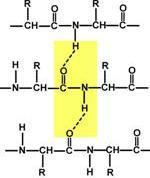 Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
α-Спираль.Данная структура является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее аминокислотных остатков.Формированию спирали препятствуют пролин и гидроксипролин, которые обуславливают "перелом" цепи, ее резкий изгиб. Высота витка спирали составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2,7 нм.
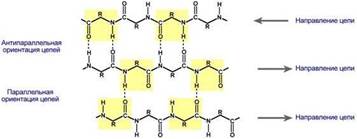 β-Складчатый слой.В этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей.Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти. В структуре глобулярных белков могут встречаться фрагменты регулярного строения всех трех типов в любой комбинации, но может не быть и ни одного. Повторяющиеся, более сложные комбинации, образованные из 3х фрагментов регулярной структуры, иногда называют супервторичной структурой.
β-Складчатый слой.В этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей.Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти. В структуре глобулярных белков могут встречаться фрагменты регулярного строения всех трех типов в любой комбинации, но может не быть и ни одного. Повторяющиеся, более сложные комбинации, образованные из 3х фрагментов регулярной структуры, иногда называют супервторичной структурой.
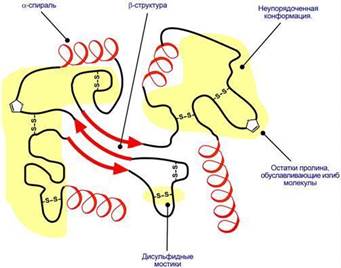 Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между АК, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между АК, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Наряду с α-спиралью и β-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур. Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% α-спирали и 45% β-структуры.
АК принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например: 1)водородные – между НО-, СООН-, NH2-группами радикалов АК (возникает между боковыми цепями АКи пептидными связями), 2) дисульфидные – между остатками цистеина (внутримолекулярная связь), 3)гидрофобные – между остатками алифатических и ароматических АК (отражает взаим-ие неполярных групп), 3) ионные – между СОО–-группами глутамата и аспартата и NH3+-группами лизина и аргинина (относится к электростатическим вз-ям), 4) псевдопептидные – между дополнительными СОО–группами глутамата и аспартата и дополнительными NH3+группами лизина и аргинина.
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфор-мации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её на-тивной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается. В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами
3. Четвертичная структура белков. Кооперативные изменения конформации протомеров. Примеры строения и функционирования олигомерных белков: гемоглобин (в сравнении с миоглобином), аллостерические ферменты.
Четвертичная структура - это и количество, и способ укладки полипептидных цепей (протомеров) в пространстве. Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой.Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
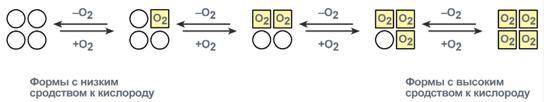 Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждый протомер взаимодействует с другим во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение О2 к гемоглобину. В тканях отдача О2 также ускоряется в 300 раз. Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и т.д. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.
Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждый протомер взаимодействует с другим во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение О2 к гемоглобину. В тканях отдача О2 также ускоряется в 300 раз. Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и т.д. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами (обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение; они имеют аллостерический центр, пространственно удалённый от каталитического активного центра; эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; аллостерические ферменты обладают свойством кооперативности: регуляция аллостерических ферментов обратима). Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Связь между структурой белка и его функцией можно рассмотреть на примере двух родственных белков: миоглобина и гемоглобина:
Миоглобин- мономер (состоит из одной полипептидной цепи), основная его функция - запасание кислорода в тканях. Имея высокое сродство к кислороду, миоглобин легко присоединяет его и отдает кислород только при интенсивной мышечной работе, когда парциальное давление кислорода падает ниже 10 мм рт. ст.
Гемоглобин - тетрамер (состоит из 4х протомеров). Основная функция гемоглобина - обратимое связывание с кислородом в легких, где парциальное давление кислорода высокое и гемоглобин взаимодействует с четырьмя молекулами кислорода.
В тканях СО2 и Н2О, образующиеся при катаболизме пищевых веществ, взаимодействуют с гемоглобином и уменьшают его сродство к кислороду, что облегчает поступление кислорода в ткани.
В эритроцитах имеется также аллостерический лиганд 2,3-дифосфоглицерат, способный взаимодействовать с дезоксигемоглобином. Это препятствует обратному связыванию освободившегося О2 с гемоглобином.
Таким образом, связывание гемоглобина с аллостерическими лигандами в тканях, при относительно высоком парциальном давлении, обеспечивает поступление кислорода в ткани.
Из рассмотренных примеров следует заключить, что аллостерический эффект является результатом связывания лиганда со специфическим участком белка. Это вызывает значительное изменение в белковой молекуле, которая в свою очередь влияет на активность другого, пространственно удаленного участка. Кооперативные изменения конформации олигомерных белков составляют основу механизма регуляции функциональной активности не только гемоглобина, но и многих других белков.
4. Понятие о ферментах. Специфичность действия ферментов. Кофакторы ферментов. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, температуры и рН. Принципы количественного определения ферментов. Единицы активности.
Ферменты– это катализаторы биологической природы (белки), которые обеспечивают протекание биохимических процессов в живых клетках. Ф. не входят в состав конечных продуктов реакции. Ф. не тратятся в процессе катализа. Ф. только ускоряют реакции, протекающие без них. Ф. не могут возбудить реакции, протекающие по законам термодинамики. Ф. не смещают положение равновеся, а лишь ускоряют его движение. Одна молекула Ф. при обычных условиях может катализировать превращение от тысячи до миллиона молекул в-ва в минуту. Простые ферменты состоят только из АК, а сложные из 2х частей: белковой (апофермент) и небелковой (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической группой, если непрочно – коферментом. Кофактор – это ионы металла или сложные органические соединения, которые выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента (Пр.: в активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого гамма-фосфорного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата).
Особенности:
1. Используются неоднократно; 2. Работают в узком диапазоне t и pH; 3. Катализируют только те реакции, которые биохимически возможны; 4. Обладают каталитической эффективностью; 5. Характерна конформационная лабильность; 6. Способность к регуляции 7. Обладаютспецифичностью: а) субстратная (абсолютная - Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату: аргиназа в реакции расщепления аргинина до мочевины и орнитина; и групповая - Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов: Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира; Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000; стереоспецифичность - При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них: к D-сахарам (гексокиназа), к L-аминокислотам, к цистрансизомерам (фумараза), к α- и β-гликозидным связям(амилаза)) В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы:
1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. 2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.
б) каталитическая - Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
Скорость биохим. реакции определяется: а) изменением концентрации реагирующих веществ в единицу времени; б) не является постоянной в течении времени.
Дата добавления: 2016-06-13; просмотров: 7580;
