Долгоживущие, генетически не связанные радионуклиды.
Калий. Состоит из трех изотопов К39,К40, К41. К-40– радиоактивный изотоп с Т1/2=1,3×109 лет, b,g – излучатель. Содержание в природе К – 0,0118%. Методы выделения из природы К-40 не разработаны. Определение К-40 – спектрометрически. К-40 вносит в настоящее время наибольший вклад в радиоактивность земной коры и вод океана. Содержание калия в организме человека составляет 0,18 %. Годовая эффективная эквивалентная доза от 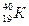 в организме равна 165 мкЗв. Основная часть дозы формируется β-излучением.
в организме равна 165 мкЗв. Основная часть дозы формируется β-излучением.
Все радионуклиды с Т1/2<108 лет существовавшие ранее в земном веществе к настоящему времени распались. Количество оставшихся радионуклидов значительно уменьшилось со времени образования земного вещества; 40К – примерно в 12 раз, 235U~ в 30 раз.
Хозяйственная деятельность человека: добыча урановых и ториевых руд, различная их переработка, применение минеральных удобрений (особенно фосфорных), использование угля, а также отходов промышленных предприятий приводят к перераспределению естественных радионуклидов в биосфере.
Рубидий (лат. Rubidium), Rb, химический элемент I группы периодической системы Менделеева; атомный номер 37, атомная масса 85,4678; серебристо-белый металл, относится к щелочным металлам. Природный Рубидий представляет собой смесь двух изотопов: стабильного85Rb (72,15%) и слаборадиоактивного 87Rb (период полураспада Т½4,8·1010лет). При β-распаде 87Rb образуется стабильный 87Sr. Определение содержания 87Sr и Рубидия в горных породах и минералах (стронциевый метод) дает возможность надежно установить их геологический возраст. Искусственно получено около 20 радиоактивных изотопов Рубидия. Рубидий открыли в 1861 году Р. Бунзен и Г. Кирхгоф при спектральном исследовании солей, выделенных из минеральных вод. Название элементу дано по цвету наиболее характерных красных линий спектра (от лат. rubidus - красный, темнокрасный). Металлический Рубидий получил впервые в 1863 году Бунзен. Химические свойства Рубидия. Атом Rb легко отдает единственный электрон внешней оболочки (ее конфигурация 5s1). Электроотрицательность Рубидий 0,89, первый потенциал ионизации 4,176 эв. Во всех химических соединениях Рубидий одновалентен (степень окисления +1). Химическая активность Рубидия очень высока. С кислородом соединяется бурно, давая пероксид Rb2O2 и надпероксид RbO2 (при недостатке кислорода образуется оксид Rb2O). С водой Рубидий реагирует со взрывом, причем выделяется водород и образуется раствор гидрооксида Рубидия, RbOH. По свойствам RbOH сильно напоминает гидрооксид калия КОН. Со многими неметаллами Рубидий соединяется непосредственно; бурно взаимодействует с большинством кислот. Почти все соли Рубидия хорошо растворимы в воде. Мало растворимы перхлорат RbClO4, хлороплатинат Rb2[PtCl5] и некоторые другие; они используются для аналитического определения Rb наряду с методом пламенной фотометрии, основанным на свойстве паров Rb и его соединений окрашивать пламя в ярко-красный цвет.
Неоди́м (лат. Neodimium), Nd (читается «неодим»), химический элемент с атомным номером 60, атомная масса 144,24. Состоит из пяти изотопов 142Nd (27,07%), 143Nd (12,17%), 145Nd (8,30%), 146Nd (17,22%) и 148Nd (5,78%) и радиоактивных изотопов 144Nd (23,78%, период полураспада Т1/2 = 5×1015 лет) и 150Nd (5,67%, период полураспада Т1/2 = 2×1015 лет). Конфигурация внешних электронных слоев 4s2p6d10f4 5s2p66s2. Степени окисления в соединениях +3 (валентность III), реже +4 и +2 (валентности IV и II).
Относится к редкоземелььным элементам (цериевая подгруппа лантаноидов). Расположен в группе III B в 6 периоде периодической системы.
Радиус нейтрального атома 0,182 нм, радиус иона Lu3+ — 0,112—0,141 нм, иона Nd2+— 0,143— 0,149 нм. Энергии ионизации 5,49, 10,72, 22,1, 40,41 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,07.
История открытия
Неодим открыл в 1885 австрийский химик К. Ауэр фон Вельсбах (см. АУЭР фон ВЕЛЬСБАХ Карл), который установил, что обнаруженный в 1839 году французским химиком К. Г. Мосандером (см. МОСАНДЕР Карл Густав) элемент дидим на самом деле представляет смесь двух элементов с близкими физическими и химическими свойствами, которым он дал названия неодим и празеодим (см. ПРАЗЕОДИМ). История открытия неодима отражена в его названии (от греч. neos — новый и didymos — двойник).
Нахождение в природе
Неодим — один из наиболее распространенных редкоземелььных элементов. Содержание его в земной коре 2,5·10-3%, в морской воде 9,2·10-6мг/л. Входит в состав минералов бастнезит (см. БАСТНЕЗИТ), монацит (см. МОНАЦИТ) и лопарит (см. ЛОПАРИТ).
Получение
При разделении редкоземелььных элементов неодим концентрируется вместе с легкими лантаноидами и выделяется вместе с празеодимом. Дальнейшее разделение проводят методами ионной хроматографии или экстракции. Металлический неодим получают электролизом расплава хлорида или фторида неодима NdF3, NdCl3.
Физические и химические свойства
Неодим — светло-серый металл. Ниже 885°C устойчива a-модификация с гексагональной решеткой типа лантана, а = 0,36579 нм и с = 1,17002 нм, выше 885°C и до температуры плавления 1016°C — b-модификация с кубической решеткой типа a-Fe. Температура кипения 3027°C, плотность a-Nd 6,908 кг/дм3.
К окислению неодим менее устойчив, чем тяжелые лантаноиды. При нагревании на воздухе быстро окисляется, образуя оксид Nd2O3. Бурно реагирует с кипящей водой с выделением водорода и образованием гидроксида Nd(OH)3:
2Nd + 6Н2O = 3Nd(OH)3 + 3Н2
При нагревании реагирует с галогенами, азотом, водородом, серой и другими неметаллами. Бурно реагирует с минеральными кислотами.
Оксид Nd2О3 обладает основными свойствами, ему отвечает основание Nd(ОН)3 средней силы. К растворимым в воде солям неодима относятся хлорид, нитрат, ацетат и сульфат, к плохо растворимым — оксалат, фторид, карбонат и фосфат.
Применение
Неодим — компонент мишметалла, легких сплавов с магнием (см. МАГНИЙ) и алюминием. (см. АЛЮМИНИЙ) Сплав неодима, железа (см. ЖЕЛЕЗО) и бора (см. БОР (химический элемент)) применяют для изготовления постоянных магнитов. Оксид и фосфат неодима — пигмент при варке цветного стекла, керамики. Оксид неодима Nd2О3 используют при варке неодимового стекла (лазерный материал), служит добавкой при получении иттрий-алюминиевых гранатов.
Дата добавления: 2016-06-02; просмотров: 1395;
