Типы связей в кристаллах
При образовании твердого тела из отдельных атомов происходит перераспределение электронов атомов. Характер перестройки электронных оболочек определяется природой взаимодействующих атомов.
Можно считать, что в образовании межатомных связей принимают участие в основном валентные электроны. В результате перераспределения электронов возникают силы, удерживающие атомы (ионы) на определенном расстоянии друг от друга. Расположение частиц (атомов, ионов) кристалла зависит от характера и величины сил, действующих между ними. Частицы располагаются в узлах решетки так, чтобы полная энергия их взаимодействия принимала минимальное значение.
Главную роль в связи атомов (ионов) кристаллов играют кулоновские силы, роль магнитных взаимодействий весьма незначительна, гравитационных — ничтожна.
Различные распределения электронов обуславливают качественно различные типы связей в кристаллах. Важнейшей величиной, характеризующей связь, является удельная энергия связи. Энергия связи численно равна работе, которую необходимо совершить, чтобы удалить частицу из кристалла. Она изменяется для разных типов связи от 0,1 до 10 эВ на одну молекулу.
При образовании кристалла сильной деформации подвергаются лишь внешние электронные оболочки атома, внутренние остаются неизменными даже при сильных внешних воздействиях на кристалл. Поэтому, рассматривая строение кристалла, говорят об ионном остове (ядро вместе с электронами внутренних оболочек) и внешних валентных электронах. Ионные остовы, имеющие положительный заряд, отталкиваются друг от друга. Силы притяжения между остовами и электронами связывают их друг с другом, образуя кристалл.
Рассматривая различные возможные типы сил связи, можно сделать обобщения относительно свойств и поведения кристаллов.
Ионная связь.Эта связь возникает в результате отрыва электрона от одного атома и присоединения его к другому. Типичными представителями этой связи являются соединения щелочных металлов с галогенами. У атома щелочного металла все электронные оболочки окажутся замкнутыми, если он потеряет «лишний» единственный валентный электрон; у атома галогена не хватает одного электрона, чтобы все электронные оболочки оказались замкнутыми. При таком электронном обмене возникшие ионы можно рассматривать как правильные сферы разных размеров. Сферическая симметрия электростатического поля обуславливает отсутствие направленности связей. Каждый ион поэтому стремится окружить себя возможно большим числом ионов противоположного знака. Таким образом, число ближайших соседей иона (следовательно, и тип структуры решетки) зависит от его размера; ионы упаковываются в решетку по принципу наиболее плотной упаковки.
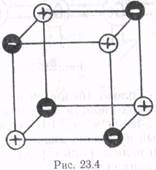 На рис. 23.4 изображена решетка с ионной связью — соединение NaCl — и показано расположение ионов Na+ и Сl– и плоскостях решетки. Положительные ионы Na+ обозначены крестиком (+), анионы Сl– - минусом (—). Ионная связь очень прочная — до 10 эВ на молекулу, для NaCl энергия связи составляет 7,9 эВ. Кристаллы с ионной связью обладают низкой прочностью, высокой твердостью, так как энергия связи обратно пропорциональна расстоянию между ионами. Низкая электропроводность (являющаяся ионной) слабо растет с повышением температуры.
На рис. 23.4 изображена решетка с ионной связью — соединение NaCl — и показано расположение ионов Na+ и Сl– и плоскостях решетки. Положительные ионы Na+ обозначены крестиком (+), анионы Сl– - минусом (—). Ионная связь очень прочная — до 10 эВ на молекулу, для NaCl энергия связи составляет 7,9 эВ. Кристаллы с ионной связью обладают низкой прочностью, высокой твердостью, так как энергия связи обратно пропорциональна расстоянию между ионами. Низкая электропроводность (являющаяся ионной) слабо растет с повышением температуры.
Ковалентная (гомеополярная) связь.Эта связь возникает между двумя атомами за счет образования общей пары валентных электронов (по одному от каждого атома).
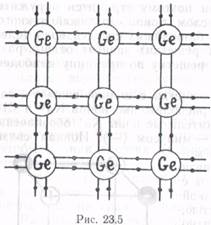
В узлах кристаллической решетки располагаются нейтральные атомы. Силы притяжения между атомами (носящие электрический характер) возникают за счет концентрации электронного облака вдоль прямых, соединяющих соседние ядра атомов, и поэтому носят направленный характер. Каждый валентный электрон атома может обеспечить связь только с одним соседним атомом, поэтому число соседей, с которыми может быть связан данный атом, равно его валентности. На рис. 23.5 приведена схема ковалентных связей кристалла германия. Четыре валентных электрона атома Ge (на рис. 23.5 они обозначены точками), обобществлены с электронами четырех ближайших соседей (по одному электрону от каждого атома на одну валентную связь). В результате такого обобществления (по 8 электронов на оболочке) электронов валентные оболочки атомов оказываются заполненными.
 Ковалентная связь может быть не только между одинаковыми атомами (Si, Ge, С), но и между атомами различных элементов (например, соединения SiC, AlN). Ковалентная связь сильная — до 10 эВ/мол. Кристаллы характеризуются высокой прочностью, высокой температурой плавления.
Ковалентная связь может быть не только между одинаковыми атомами (Si, Ge, С), но и между атомами различных элементов (например, соединения SiC, AlN). Ковалентная связь сильная — до 10 эВ/мол. Кристаллы характеризуются высокой прочностью, высокой температурой плавления.
У многих элементов наблюдается полиморфизм — один и тот же элемент может образовывать несколько кристаллических структур (в зависимости от давления и температуры). Яркие примеры полиморфизма — алмаз и графит; β — олово (белое) и α — олово (серое). Сопоставление физических свойств алмаза и графита (соответственно: плотности 3,5∙103 кг/м3 и 2,1∙103 кг/м3; прозрачный и непрозрачный; твердый и мягкий, диэлектрик и проводник) показывает, насколько велика роль структуры кристалла в проявлении его физических свойств.
Столь же резко различаются свойства белого и серого олова. Белое олово — типичный металл, атомы в узлах решетки удерживаются силами металлической связи (см. ниже); серое олово — полупроводник, имеет кристаллическую структуру с ковалентной связью.
Металлическая связь.Эта связь образуется в результате обобществления (коллективизации) валентных электронов всех атомов кристалла. В узлах кристаллической решетки металла располагаются положительные ионы. Валентные электроны, не связанные с определенным атомом, способны передвигаться по всему объему металла, образуя «электронный газ». Этот отрицательно заряженный газ «цементирует» положительные ионы под влиянием двух противоположных факторов: стягивающего действия коллективизированных электронов и сил отталкивания между ионами, последние располагаются на некотором равновесном расстоянии друг от друга, соответствующем минимуму потенциальной энергии такой системы частиц.
Кристаллы с металлической связью достаточно прочны, обладают высокой электро- и теплопроводностью. Металлическая связь несильная, ее энергия около 1 эВ/атом.
Молекулярная связь.В кристаллах с молекулярной связью в узлах кристаллической решетки располагаются молекулы (атомы), причем расстояние между молекулами значительно превосходит их размеры. Молекулярная связь возникает за счет сил взаимодействия собственных или индуцированных при взаимной поляризации электрических моментов (электрический момент диполя — системы двух равных противоположных зарядов q, находящихся на расстоянии l друг от друга, равен p = ql). Силы взаимодействия между диполями называют силами Ван-дер-Ваальса. Эти силы короткодействующие, пропорциональные l -7.
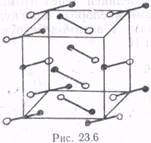 На рис. 23.6 изображена примерная структура кристалла йода. Молекула йода изображена в виде диполя, один конец которого имеет положительный заряд (черный шарик), другой - отрицательный (белый шарик). Центры молекул, находящихся в узлах, совпадают с узлами ромбической гранецентрированной решетки.
На рис. 23.6 изображена примерная структура кристалла йода. Молекула йода изображена в виде диполя, один конец которого имеет положительный заряд (черный шарик), другой - отрицательный (белый шарик). Центры молекул, находящихся в узлах, совпадают с узлами ромбической гранецентрированной решетки.
Взаимодействие Ван-дер-Ваальса слабое, оно характеризуется энергией связи порядка 0,1 эВ/мол. Кристаллы с молекулярной связью имеют низкую температуру плавления, легко разрушаются, практически не проводят ток.
Водородная связь.В особый вид межмолекулярного взаимодействия выделяется водородная связь благодаря некоторым уникальным свойствам атома водорода: малости ядра (протон в 105 раз меньше любого другого ионного остатка); большой энергии, необходимой для ионизации атома, наконец, тем, что атому нехватает одного электрона для устойчивой конфигурации двухэлектронной оболочки атома (по типу гелия). Эти свойства и обуславливают особую роль водорода при образовании кристаллических структур: атом водорода при образовании кристалла не теряет электрон (как щелочные металлы), а делится им с другим атомом и благодаря своей малости как бы «прилипает» к поверхности больших отрицательных ионов. В результате возникают структуры, которые не могут быть образованы никакими другими положительными ионами.
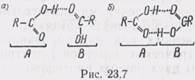 На рис. 23.7 показана водородная связь (символизируется точками) между двумя молекулами А и В (R — углеводородный радикал). Атом водорода, химически связанный (связь изображена сплошной линией) с молекулой А, одновременно взаимодействует с атомом кислорода молекулы В. Такая связь может быть как одинарной (рис. 23.7, а), так и двойной (рис. 23.7,6).
На рис. 23.7 показана водородная связь (символизируется точками) между двумя молекулами А и В (R — углеводородный радикал). Атом водорода, химически связанный (связь изображена сплошной линией) с молекулой А, одновременно взаимодействует с атомом кислорода молекулы В. Такая связь может быть как одинарной (рис. 23.7, а), так и двойной (рис. 23.7,6).
Водородная связь между молекулами воды побуждает их ассоциироваться в группы из двух, четырех или восьми молекул, что и обуславливает аномальные физические свойства воды и льда.
На рис. 23.8 две молекулы воды А и В соединены водородной связью. На рис. 23.9 атом кислорода молекулы воды А соединен через атомы водорода с четырьмя другими атомами кислорода молекул В. В результате каждая из молекул воды А взаимодействует с четырьмя соседними молекулами В.
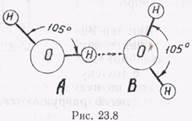
Свойства сегнетоэлектриков, структура белковых молекул и многих веществ обусловлены водородными связями молекул. Очень важна эта связь в биологических процессах, так как водородные связи легко возникают и рвутся. (Свойства протеинов и нуклеиновых кислот объясняются водородной связью.)
Энергия водородной связи около 0,5 эВ/атом.
Дата добавления: 2016-05-25; просмотров: 12257;
