Жидкостная экстракция
Лекция ЭКСТРАКЦИЯ.
Экстракция – процесс извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей (экстрагентов). При взаимодействии с экстрагентом в нем хорошо растворяются только извлекаемые компоненты и значительно слабее или практически вовсе не растворяются остальные компоненты исходной смеси. Экстракцию из твердых тел жидкостью (растворителем) называют экстрагированием. Если в этом процессе в качестве растворителя используется вода, то такой процесс называется выщелачиванием. В химической технологии экстракция из растворов экстрагентами более распространена, чем экстракция из твердых тел.
Жидкостная экстракция
Процессы жидкостной экстракции применяются в химической, нефтехимической, фармацевтической, гидрометаллургической и других отраслях промышленности получении редких и рассеянных элементов из растворов. Жидкостная экстракция, наряду с перегонкой, является одним из основных методов разделения однородных жидких смесей. Процесс экстракции обычно экономически выгоднее ректификации, поскольку при экстракции не нужно испарять всю жидкую смесь. Обычно жидкостную экстракцию с сочетают с ректификацией, которую применяют для регенерации экстрагента. Экстракт – раствор извлеченных веществ в экстрагенте, рафинат – остаточный исходный раствор.
На рис. 4.1 представлена схема без регенерации. Чаще всего используются схемы с регенерацией экстрагента.
Исходный раствор 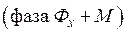 и экстрагент
и экстрагент 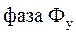 подается в экстракционный аппарат – экстрактор, в котором происходит перенос вещества М из фазы
подается в экстракционный аппарат – экстрактор, в котором происходит перенос вещества М из фазы 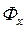 в фазу
в фазу 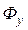 . В результате, получают экстракт
. В результате, получают экстракт 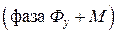 и рафинат
и рафинат 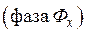 .
.
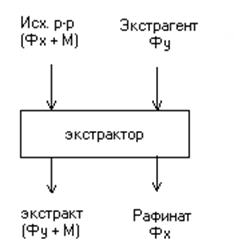
Рис. 4.1. Схема проведения экстракции.
4.1.1 Равновесия в системе жидкость – жидкость.
Для трехкомпонентной системы жидкость – распределяемое вещество–жидкость 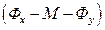 можно изменять концентрацию одной из фаз без нарушения равновесия. По правилу фаз Гиббса:
можно изменять концентрацию одной из фаз без нарушения равновесия. По правилу фаз Гиббса:
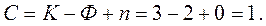
В процессе жидкостной экстракции обычно Т не меняется, Р на равновесие системы не влияет. По этому для экстракции 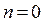 .
.
Данной концентрации распределяемого вещества х в одной фазе в состоянии равновесия соответствует определенная концентрация 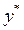 вещества в другой фазе. Эта связь соответствует закону распределения: отношение равновесных концентраций распределяемого между двумя жидкими фазами вещества при Т=const есть величина постоянная:
вещества в другой фазе. Эта связь соответствует закону распределения: отношение равновесных концентраций распределяемого между двумя жидкими фазами вещества при Т=const есть величина постоянная:

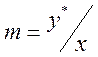 или
или 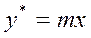 (4.1)
(4.1)
где у* и х – равновесные концентрации распределяемого вещества соответственно в экстракте и рафинате, m – коэффициент распределения.
По формуле (4.1) линия равновесия должна быть прямой, выходящей из начала координат.
Однако это справедливо для случая полной взаимной нерастворимости участвующих в процессе фаз, что довольно редко встречается в реальных условиях.
Обычно m зависит от концентрации распределяемого вещества при Т=const, если же меняется и Т, то величина m может меняться еще сильнее.
Линии равновесия на диаграмме у-х при постоянной температуре называют изотермами экстракции (рис. 4.2). Если известны изотермы для разных Т, то становится возможным выбрать наиболее приемлемое Т.
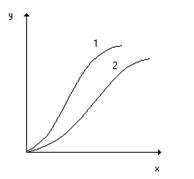
Рис.4.2. Типичные изотермы экстракции неэлектролитов (1) и электролитов (2).
Треугольные диаграммы. Составы тройных смесей в состоянии равновесия удобно изображать в треугольной диаграмме Гиббса. Отметим, что часто фазы, участвующие в процессе экстракции, частично растворимы друг в друге. Тогда экстракт помимо экстрагента и растворенного вещества содержит еще некоторое количество растворителя из исходного раствора, а рафинат помимо первоначального раствора и некоторого количества растворенного вещества – определенное количество экстрагента. Оба раствора состоят из трех компонентов.
А, В, С – чистые компоненты.
В точке А – чистый Фх,
в точке В – чистый М,
в точке С – чистый Фу.
Точки на площади треугольника соответствуют составам трехкомпонентных растворов.
Определим концентрации компонентов в точке М. Для этого через точку М проведем параллельные линии к линиям АВ, ВС и АС до пересечения. При этом отрезок 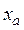 определяет концентрацию компонент А в точке М,
определяет концентрацию компонент А в точке М, 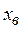 – компонента В,
– компонента В, 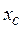 – компонента С.
– компонента С.
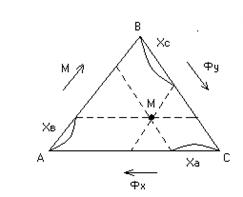
Рис. 4.3. Треугольная диаграмма.
С помощью треугольных диаграмм, используя правила рычага, можно достаточно просто определить не только состав, но и количество (массу) фаз (рис.4.4).
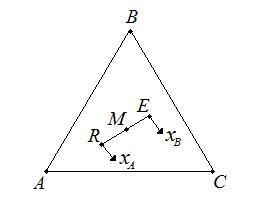
Рис.4.4. Правила рычага на треугольной диаграмме.
Средний состав смеси, образующихся при смешении двух трехкомпонентных смесей (например, состава R и E) лежит на отрезке прямой, соединяющей эти точки (например, состава М). Эта точка М по правилу рычага разделяет отрезок на отрезки, обратно пропорциональные количествам (массам) исходных смесей. При разделении М кг смеси 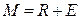 по правилу рычага имеем:
по правилу рычага имеем:
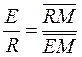 (4.2)
(4.2)
где R и E – количества рафината и экстракта соответственно, кг. Выражение (4.2) позволяет найти положение точки М, если известны количества растворов R и E.
Кривая равновесия
При расчете процесса экстракции, как и для любого массообменного процесса, необходимо знание равновесных концентраций.
Рассмотрим кривую равновесия в треугольной диаграмме.
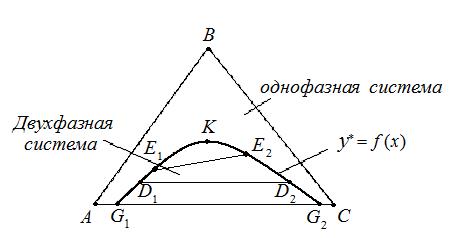
Рис. 4.5. Равновесная кривая в треугольной диаграмме.
А – 100% - растворитель в исходном растворе, В – 100% - растворенное вещество, С – 100% - экстрагент.
Линии АВ, ВС, СА – характеризуют состав двухкомпонентных растворов. Пусть А и В, В и С, неограниченно растворимы друг в друге,
а А и С – ограниченно растворимы.
На участке G1 и G2 любая смесь компонентов А и С расслаивается на два однородных двухкомпонентных раствора, состава которых отвечают точкам G1 и G2 . Если к ним добавить В, получим трехкомпонентный расслаивающий раствор соответствующий точкам D1 и D2. Хорда соединяющие точки D1 и D2 соответствует растворам, находящихся в равновесии друг с другом. При дальнейшим добавлении компонента В получим расслаивающиеся системы характеризующиеся точкам Е1 и Е2 и т.д. Эти точки постепенно сближаются, наконец соединятся в точке К. Точка К– критическая точка, соответствует однофазному раствору.
Соединяя точки G1 , D1 , Е1 , … , G2 , D2 , Е2 и т.д. получают равновесную (бинодальную) кривую, выше которой система однофазна и для процесса экстракции интереса не представляет.
Хорды, соединяющие точки D1 и D2 , E1 и E2 и т.д. на бинодальной кривой, называют конодами, которые непараллельны друг другу, так как компонент В неравномерно распределяется между компонентами А и С. Любая точка, лежащая на площади, ограниченной равновесной кривой кривой, соответствует двухфазной системе
Взаимная растворимость с увеличением температуры повышается, поэтому область существования гетерогенных систем уменьшается. При высоких температурах может вообще исчезнуть (точка Ткр на рис. 4.6).
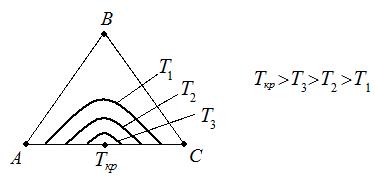
Рис. 4.6. Влияние Т на равновесную кривую.
Селективность экстрагента. Основным свойством экстрагента является селективность, которая характеризует его способность преимущественно извлекать один из двух, трех и более компонентов раствора. Селективность С по отношению к В выражается отношением концентраций компонентов В и А в фазе экстракта 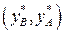 , разделенным на отношение концентраций в фазе рафината
, разделенным на отношение концентраций в фазе рафината 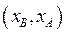 .
.
Селективность экстрагирования по отношению к распределяемому компоненту характеризуется коэффициентом селективности (коэффициент разделения) 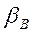 :
:
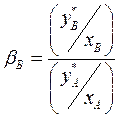 (4.3)
(4.3)
или с учетом (4.1)

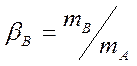 (4.4)
(4.4)
Как видно, чем больше 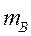 тем больше
тем больше 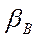 . Если
. Если 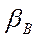 =1, то селективность равна 0. В реальных условиях
=1, то селективность равна 0. В реальных условиях 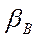 больше 2. Увеличение
больше 2. Увеличение 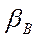 можно добиться изменением рН раствора.
можно добиться изменением рН раствора.
4.1.2 Материальный баланс процесса жидкостной экстракции.
Однократная (одноступенчатая) экстракция.
Рассмотрим одноступенчатую (однократную) экстракцию. Этот простейший метод заключается в том, что исходный раствор F и экстрагент S перемешивается в смесителе, после чего разделяется на два слоя: экстракт E и рафинат R:
F + S = E + R (4.5)
Здесь F,S – количество исходного раствора и экстрагента соответственно кг.
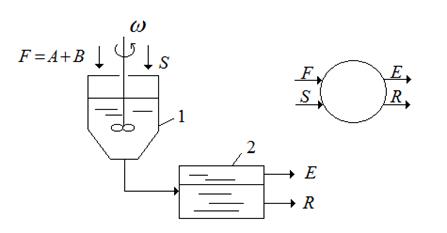
Рис. 4.7 Схема одноступенчатой экстракции: 1 – смеситель, 2 – отстойник (сепаратор).
Фазы, участвующие в жидкостной экстракции, обладают частичной взаимной растворимостью. Тогда система как минимум является трехкомпонентной. Для трехкомпонентной смеси используется треугольная диаграмма. Уравнение (4.5) можно переписать как:
F + S = N = R + E (4.6)
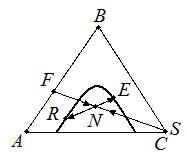
Рис. 4.8. К выводу уравнения материального баланса.
Выражение (4.6) позволяет представить материальный баланс на треугольной диаграмме как процесс смешения потоков F + S = N и затем разделения этой тройной смеси состава N на потоки R + E. По правилу рычага можно записать:
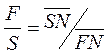 (4.7)
(4.7)
Тогда при заданной F находим необходимое значение S для процесса. Соотношение потоков Е и R находят по формуле
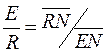 (4.8)
(4.8)
Материальный баланс компонентов А и В в потоках экстракта Е и рафината R с учетом рис.4.3 имеет вид:
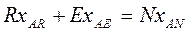
(4.9)
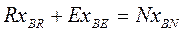
Так как сумма концентраций всех трех компонентов А, В, С равна 100%, то мат. баланс по компоненту С не нужен. Учитывая, что N = E + R получим:
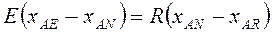
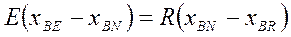
Разделив одно на другое получим:
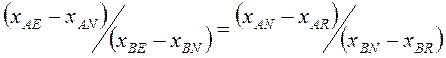 (4.10)
(4.10)
Уравнение (4.10) является уравнением прямой линии. По уравнениям (4.7) – (4.10) можно найти состав любого потока, если известны количества и состав трех остальных потоков.
4.1.3 Кинетика жидкостной экстракции.
Поскольку при экстракции
- массообмен происходит между двумя жидкими фазами,
- для развития поверхности фазового контакта обычно одну из жидкостей диспергируют.
- 1. распределяемое вещество В переходит из сплошной фазы к поверхности капли и затем внутрь ее
- 2. или (наоборот) из капли через поверхность раздела фаз в ядро потока сплошной фазы.
В соответствии с общим уравнением массопередачи количество проходящего из одной фазы в другую вещества можно записать:
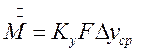 (4.11)
(4.11)
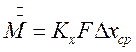
 (4.12)
(4.12)
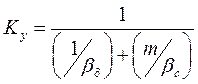 (4.13)
(4.13)
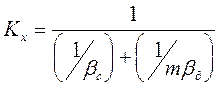 (4.14)
(4.14)
Здесь 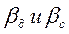 - коэффициенты массоотдачи для дисперсной фазы и сплошной фазы.
- коэффициенты массоотдачи для дисперсной фазы и сплошной фазы.
Поскольку поверхностью контакта фаз при экстракции являются капли, то массоперенос осуществляется через сферическую поверхность. Очевидно, что гидродинамические условия внутри капли и в сплошной фазе различны. Поэтому массоперенос в пределах каждой из фаз не может быть описан идентичным уравнением. Рассмотрим частные случаи.
Случай первый – диффузионное сопротивление внутри капли незначительное по сравнение диффузионным сопротивлением в сплошной фазе, тогда 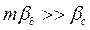 , следовательно
, следовательно 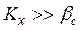 . Коэффициент массоотдачи
. Коэффициент массоотдачи 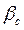 может быть определен по критериальному уравнению:
может быть определен по критериальному уравнению:
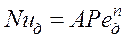 (4.15)
(4.15)
Случай второй – диффузионное сопротивление внутри капли велико, в то время как диффузионное сопротивление сплошной фазы незначительно, тогда 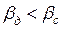 . В этом случае
. В этом случае 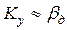 . Коэффициент массотдачи
. Коэффициент массотдачи 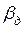 определяется по аналогичному уравнению (4.15).
определяется по аналогичному уравнению (4.15).
Случай третий – диффузионные сопротивления сплошной фазы и внутри капли примерно равны. В этом случае необходимо использовать уравнения (4.11) и (4.13) или (4.12) и (4.14).
4.1.3 Основные способы проведения жидкостной экстракции.
Однократная (одноступенчатая) экстракция.
Простейшим способом проведения процесса экстракции является одноступенчатая экстракция (рис.4.7). Исходная смесь и экстрагент вводятся в смеситель 1, где происходит диспергирование и процесс массопередачи, а затем переходит в сепаратор 2, в котором разделяются на две фазы: рафинат и экстракт. Процесс может проводиться как непрерывно, так и периодически. Структура потоков в смесителе близка к МИС и выходящие из аппарата фазы экстракта и рафината находится в состоянии равновесия.
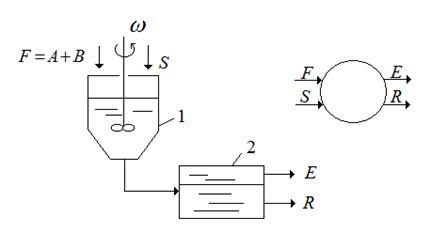
Рис. 1.7 Одноступенчатая экстракция
Многоступенчатая экстракция с перекрестным током растворителя.
Исходный раствор и соответствующие рафинаты обрабатывают порцией свежего экстрагента 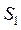 и
и 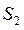 и т. д. На каждой ступени экстракции, состоящей из смесителя и отстойника, причем рафинаты направляют последовательно в следующие ступени , а экстракты
и т. д. На каждой ступени экстракции, состоящей из смесителя и отстойника, причем рафинаты направляют последовательно в следующие ступени , а экстракты 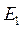 и
и 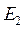 и т. д. после каждой ступени выходят из колонны.
и т. д. после каждой ступени выходят из колонны.
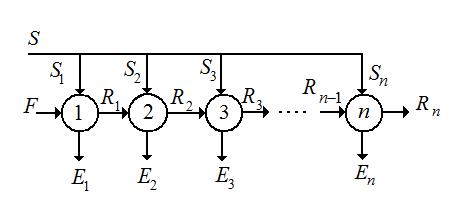
Рис. 4.9 Схема многократной экстракции с противоточным током растворителя (1,2 … n – ступени).
По этому способу можно полностью извлечь из исходного раствора распределяемый компонент и получить чистый рафинат. Однако, неизбежны потери растворителя, содержащегося в исходном растворе, так как в каждой ступени происходит частичное удаление растворителя экстрактом.
Многократная экстракция с противоточным движением растворителя.
Этот способ проведения экстрагирования характеризуется многократным контактированием в ступенях 1, 2 и т. д. при противоточном движении потоков рафината R и экстракта Е при условии подачи исходного раствора F и и экстагента S с противоположных концов.
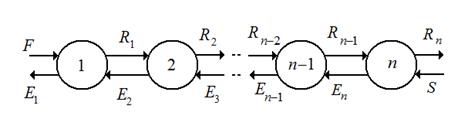
Рис. 4.10 Схема многократной экстракции с противоточным движением растворителя (1,2 … n – ступени).
Можно получить продукты заданного свойства при высокой производительности установки.
Непрерывная противоточная экстракция.
Такой способ экстрагирования осуществляют в аппаратах колонного типа (например, насадочных). Более тяжелый раствор поступает сверху, а в нижнюю часть колонны поступает легкая фаза (рис.4.11).
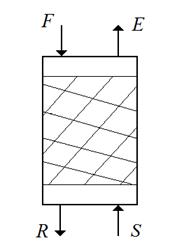
Рис.4.11. Схема непрерывной противоточной экстракции.
При непрерывной противоточной экстракции фазы взаимодействуют друг с другом не достигая равновесия. Противоточное движение фаз при экстракции обеспечивает большую степень извлечения распределенного компонента В, чем прямоточное.
Дата добавления: 2016-05-25; просмотров: 4644;
