Пригодности воды для хозяйственно-питьевого водоснабжения. Оценка агрессивности подземных вод
Для гидрогеологических исследований данные о химическом составе подземных вод чрезвычайно важны. Химический анализ является основой для изучения генезиса подземных вод, оценки пригодности их для бытовых и промышленных нужд, лечебных целей, агрессивности по отношению к бетонным и металлическим конструкциям. Выбор типа анализа подземных вод (полевые сокращенные и полные общие, специальные) зависит от задач и целей исследований. Они могут проводиться как в полевых, так и в стационарных условиях.
Результаты химических анализов воды выражают в весовой, эквивалентной и процент - эквивалентной формах.
Весовая форма представляет собой отражение ионно-солевого состава воды как содержания в ней определенных количеств отдельных ионов в миллиграммах на 1 л (дм3)раствора или 1 кг воды.
Эквивалентная форма записи состава вод позволяет выполнить соотношение между ионами с точки зрения их участия в химических реакциях, оценить качество анализа и вычислить содержание некоторых макрокомпонентов без непосредственного их определения. На основе эквивалентной формы часто устанавливают генезис природных вод.
Расчет эквивалентной формы основан на понятии химического эквивалента. Химическим эквивалентом Э называется такое количество вещества, которое вступает в химические реакции взаимодействия с 1 частью ионов Н+ или 8 частями ионов О2- по массе. Вычисляется Э как отношение атомного веса иона, выраженного в граммах, к абсолютной величине его заряда. Химический эквивалент, выраженный в граммах, представляет собой количество вещества, обладающее таким же суммарным зарядом, как и 6,2*1023 (число Авагадро) частиц однозарядного иона.
В гидрогеологических и гидрологических исследованиях в качестве эквивалентной формы используется миллиграмм - эквивалентная, т.е. количество миллиграмм-эквивалентов иона в 1 л (дм3) раствора:
[мг-экв/дм3] = [мг/дм3*1/Э] = [мг/дм3*К],
где Э – химический эквивалент иона; К – переводной коэффициент, К=1/Э (таблица 4).
Таблица 4 - Эквиваленты и переводные коэффициенты наиболее распространенных ионов природных вод
| Ион | Э | К | Ион | Э | К |
| Na+ | 23,0 | 0,0435 | Cl- | 35,5 | 0,0282 |
| K+ | 39,1 | 0,0256 | SO42- | 48,0 | 0,0208 |
| Mg2+ | 12,2 | 0,0822 | HCO3- | 61,0 | 0,0184 |
| Ca2+ | 20,0 | 0,0499 | Br- | 79,6 | 0,0125 |
| NH4+ | 18,0 | 0,0556 | I- | 126,9 | 0,0079 |
| H+ | 1,0 | 1,0 | CO32- | 30,0 | 0,0328 |
| Fe2+ | 18,6 | 0,0538 | NO3- | 62,1 | 0,0161 |
| Fe3+ | 27,9 | 0,0358 |
На основе эквивалентной формы выражения концентрации ионов можно оценить погрешность химического анализа воды. Основана эта оценка на принципе электронейтральности раствора, исходя из которого сумма концентраций катионов (положительно заряженных ионов), выраженных в миллиграмм - эквивалентах на литр, должна быть равна сумме содержания анионов (отрицательно заряженных ионов), представленных также в эквивалентной форме: 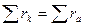 .
.
Однако реальный химический анализ не всегда обеспечивает достаточную точность и поэтому равенство не выполняется. Ошибка анализа
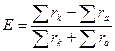 .
.
Анализ воды считается кондиционным (выполненным качественно), если погрешность Е<5%. Контроль по формуле возможен только в тех случаях, когда проведено раздельное определение каждого основного иона (макрокомпонента).
Часто, особенно в полевых условиях, невозможно провести определение таких макрокомпонентов, как Na+ и K+. Тогда сумму этих ионов, основываясь на принципе электронейтральности, вычисляют как разность:
r (Na++K+)= 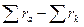 ,
,
где 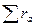 - сумма концентраций основных анионов;
- сумма концентраций основных анионов; 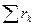 - сумма концентраций всех основных катионов, определенных в ходе анализа (обычно Ca2+, Mg2+).
- сумма концентраций всех основных катионов, определенных в ходе анализа (обычно Ca2+, Mg2+).
Процент - эквивалентная форма показывает относительную долю участия того или иного иона в формировании ионно-солевого состава воды. Ее получают из эквивалентной. Для вычисления процентного содержания анионов их сумму принимают за 100% и рассчитывают процент содержания каждого аниона по отношению к их сумме. Для катионов проводят аналогичные вычисления.
Процент - эквивалентная форма наглядно представляет ионно-солевой состав воды, соотношения между ионами, а также позволяет устанавливать черты сходства вод, различающихся по минерализации. Кроме того, она является основной для систематизации химических анализов в виде формул и графиков.
Определение общей минерализации воды
Минерализация воды М – это сумма минеральных веществ в граммах или миллиграммах, содержащихся в 1 л (дм3) воды. Для определения М суммируют содержание всех ионов, определенных химическим анализом и выраженных в весовой форме.
По минерализации воды подразделяются на следующие группы [6]:
| Воды | Минерализация, М, г/дм3 |
| Пресные | <1 |
| Солоноватые | 1-10 |
| Соленые | 10-35 |
| Рассолы | >35 |
Определение видов жесткости
Жесткость воды определяется присутствием в ней солей Ca2+ и Mg2+. Для вод, используемых в хозяйственных и технических целях, жесткость имеет большое значение. Различают общую, карбонатную, устранимую (временную), некарбонатную, неустранимую (постоянную) жесткости.
Общая жесткость Ж0 определяется как сумма миллиграмм-эквивалентов ионов Ca2+ и Mg2+ в 1 л (дм3) воды и слагается она из карбонатной (Жк) и некарбонатной (Жнк):
Ж0 = Жк + Жнк; Ж0 = rCa2+ + rMg2+.
Устранимая (временная) и карбонатная жесткости вызываются наличием в воде одних тех же гидрокарбонатных и карбонатных солей кальции и магния. Разница между ними заключается в том, что устранимая жесткость есть величина экспериментальная, показывающая, насколько уменьшилась общей жесткостью после длительного кипячения пробы, в карбонатная жесткость является величиной расчетной. Устранимая жесткость всегда меньше карбонатной.
Для определения карбонатной жесткости необходимо учитывать два возможных соотношения между суммами миллиграмм – эквивалент
1) если [rCa + rMg] 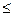 [rHCO3- + rCO32-], то карбонатная жесткость равна общей жесткости, поскольку больше общей жесткости она не может быть
[rHCO3- + rCO32-], то карбонатная жесткость равна общей жесткости, поскольку больше общей жесткости она не может быть
Жо = Жк=rCa2+ + rMg2+;
2) если [rCa2+ + rMg2+] > [rHCO3- + rCO32-], то карбонатная жесткость воды меньше общей жесткости и эквивалентны содержанию rHCO3- + rCO32-, т.е. Жк = rHCO3- + rCO3 2-.
Неустранимая (постоянная) жесткость равна разности между общей жесткостью и устранимой. Некарбонатная жесткость равна разности между общей жесткостью и карбонатной.
Подземные воды по общей жесткости подразделяются на пять групп (по О.А. Алекину) [6]:
| Вода | Жо, мг-экв/дм3 |
| Очень мягкая | >1,5 |
| Мягкая | 1,5 – 3,0 |
| Умеренно жесткая | 3,0 – 6,0 |
| Жесткая | 6,0-9,0 |
| Очень жесткая | >9,0 |
Формула Курлова
Для наглядного изображения химического состава подземных вод используется формула Курлова, которая представляет собой псевдодробь, в числителе которой слева направо записывают анионы в процент - эквивалентах в порядке их убывания, а в знаменателе в том же порядке – катионы. Количество анионов и катионов округляется до целых чисел. Слева от дроби записывают минерализацию в граммах на литр, а также содержание в миллиграммах на литре некоторых специфических компонентов и газовый состав. Справа от дроби указывается величина рН воды и ее температура. Формула Курлова для воды Мирового океана, например, имеет вид
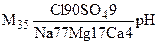
По формуле Курлова дается название воды. В него включают все ионы (сначала анионы, затем катионы), содержание которых превышает 25%.Согласно Е.В. Посохову «… при составлении химического названия воды необходимо соблюдать элементарные правила русского языка, согласно которым основное прилагательное пишется полностью, а прилагательное, указывающее на второстепенное свойство предмета, пишется сокращенно» [9]. Если в химическом составе воды преобладают хлоридные и сульфатные анионы, причем сульфатного больше, то воду следует называть хлоридно-сульфатной. Так, если химический состав воды записан в виде формулы Курлова следующим образом:
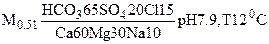 ,
,
то данная вода будет называться гидрокарбонатной магниево-кальциевой, пресной, с щелочной реакцией.
Оценка пригодности воды для хозяйственно-питьевого водоснабжения
Оценка пригодности вод, используемых для хозяйственно-питьевого водоснабжения, производится по органолептическим, токсикологическим и микробиологическим показателям. Согласно требованиям к качеству таких вод регламентируется СанПиНом 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
Органолептические показатели, могущие вызвать неприятные (нежелательные) ощущения (запах, привкус, цвет, мутность), нормированы следующим образом: запах при 20 0С и нагревании до 60 0С не должен превышать 2 балов; цветность по платиново-кобальтовой шкале должна быть не более 200; мутность по стандартной шкале не более 1,5 мг/дм3.
Концентрации химических веществ, влияющих на органолептические свойства воды, не должны превышать следующих нормативов [11]:
| Компоненты воды | Норматив |
| Железо Fe, мг/дм3 | 0,3 (1,0)* |
| Марганец Mn, мг/дм3 | 0,1 (0,5)* |
| Медь Cu, мг/дм3 | 1,0 |
| Сульфаты SO42-, мг/дм3 | |
| Хлориды Cl-, мг/дм3 | |
| Цинк Zn, мг/дм3 | 5,0 |
| Жесткость общая, мг-экв/дм3 | 7,0 |
| Водородный показатель рН | 6 - 9 |
*- Величина, указанная в скобках, может быть установлена на постановлению главного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании санитарно-эпидемиологической обстановки в населенном пункте и применяемой технологии водоподготовки.
Токсикологические показатели качества воды характеризуют безвредность ее химического состава для человеческого организма. Концентрации в воде токсичных химических веществ определяются следующими нормативами [11]:
| Показатели | Норматив, мг/дм3 |
| Алюминий Al | 0,5 |
| Бериллий Be | 0,0002 |
| Молибден Mo | 0,25 |
| Мышьяк As | 0,05 |
| Нитраты NO3- | |
| Свинец Pb | 0,03 |
| Селен Se | 0,01 |
| Стронций Sr | 7,0 |
| Ртуть Hg | 0,0005 |
| Фтор F для климатических районов: I и II III | 1,5 1,2 |
Микробиологические показатели, характеризующие бактериальный биоценоз воды, должен соответствовать следующим нормам [9]:
1) общее количество бактерий в 1 мл неразбавленной воды не более 100;
2) коли-титр (количество воды, в котором встречается одна бактерия кишечной палочки типа Coli) не менее 300 г;
3) коли-индекс (количество бактерий группы кишечной палочки типа Coli в 1 л (дм3) воды) – не более 3.
Если питьевая вода не отвечает требования, то соответствующей обработкой (осветление, обесцвечивание, опреснение, фторирование, умягчение и т.д.) ее доводят до необходимых кондиций.
Оценка агрессивности подземных вод
Воды определенного химического состава могут оказывать разрушающее действие на бетонные и металлические конструкции, фильтры скважин, обсадные трубы, насосы и т.д.
Агрессивное действие вод на бетон проявляется в растворении его основного компонента – карбоната кальция, а также в образовании солей CaSO4*2H2O; MgSO4*2H2O и сульфоалюмината кальция («цементной бациллы»),вызывающего вспучивание и крошение бетона. Это явление характерно для подземных вод с повышенным содержанием иона SO42-.
В зависимости от присутствия в воде тех или иных компонентов различают несколько видов агрессивности подземных вод к бетону (таблица 5).
Таблица 5 - Виды агрессивности подземных вод по отношению к бетону [10]
| Виды агрессивности | Признаки агрессивности |
| Сульфатная | Повышенное содержание иона SO42- |
| Магнезиальная | То же, Mg2 |
| Общекислотная | Низкие значения рН (рН<5 для бетона марки W4) |
| Углекислотная | Наличие агрессивной углекислоты СО2 более 10 мг/дм3 |
| Выщелачивающая | Низкое содержание иона НСО3- |
Степень агрессивного воздействия подземных вод на арматуру железобетонных конструкций оценивается по суммарному содержанию в них сульфатов и хлоридов.
Количественные критерии оценки вида и степени агрессивности подземных вод к бетону и железобетону приводятся в СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» и ГОСТ 9.602-2005 «Единая система защиты от коррозии и старения. Сооружения подземные. Общие требования к защите от коррозии».
Задание
Обработать химический анализ воды (таблица 6), выраженные в весовой форме.
Дата добавления: 2016-05-16; просмотров: 2945;
