Динамическая подвижность белков
Малые колебания атомов в твердом теле происходят с высокими частотами w0 ~1013- c-l(tau ~ 1013с) и малыми амплитудами ха ~ 0,01-0,1 А - (обычные гармонические колебания). Такой подход неприменим для описания микродвижений белка с амплитудами ха » 0,1 А. Смещение отдельного фрагмента белка на величину, большую чем 0,1 А, возможно только, если оно одновременно сопровождается образованием флуктуационной полости из-за сдвига других молекулярных групп, окружающих данный фрагмент. Фрагмент белка как бы "расталкивает" соседние группы. Такое движение требует энергии активации для преодоления потенциальных энергетических барьеров, препятствующих смещению фрагмента. Поскольку переход из одного микросостояния в другое сопровождается большими смещениями (~1А), то и ширина барьера должна быть довольно большой. Такой процесс перехода нельзя уподобить "одноактному" перескоку между двумя микроинформационными состояниями. Переход через широкий барьер - непрерывный процесс движения в потенциальном поле со сложным рельефом - частой потенциальной гребенкой (картинка 1). 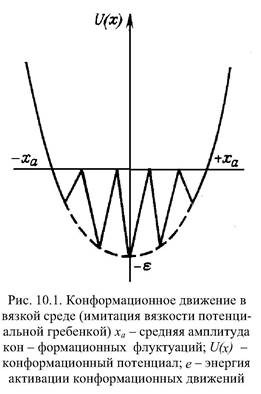
Т.о., движение фрагмента белка характеризуется двумя пространственными масштабами. Движение по "частоколу" из частых потенциальных барьеров отражает взаимодействие фрагмента с окружающими белковыми группами. Оно носит диффузионный характер и характеризуется коэффициентом конформационной диффузии D(x), зависящим от окружающей среды или от конформационной координаты х. Другой пространственный масштаб отражает результирующее медленное перемещение вдоль самой конформационной координаты и происходит в конформационном потенциале и (х). Как Выход за пределы конформационной энергетической ямы [-ха, ха,] запрещен, так как связанный с остальной белковой молекулой фрагмент не может отойти как угодно далеко. Такое движение соответствует непрерывной ограниченной диффузии в вязкой среде, когда фрагмент испытывает действие случайных толчков или теплового шума. Временная зависимость среднего квадратичного смещения [x(t)]2 в этом процессе определяется формулой 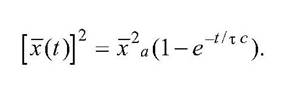
Здесь х2 а - средний квадрат амплитуды смещения, тс - характерное время релаксации в процессе ограниченной диффузии, зависящее от трения при движении 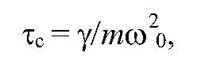 .
.
Где y - коэффициент трения, пропорциональный микровязкости белка, т - масса фрагмента, w0 - частота колебаний. Коэффициент трения зависит от микровязкости белка согласно формуле Стокса
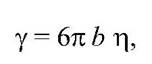
где b - характерный линейный размер фрагмента (b ~ 1 - 10А), ню - вязкость в пуазах (пз). Повышение температуры экспоненциально уменьшает вязкость –

(эпсилон - энергия активации вязкого течения).
 С ростом температуры экспоненциально уменьшается и время тс.
С ростом температуры экспоненциально уменьшается и время тс. 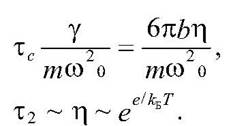
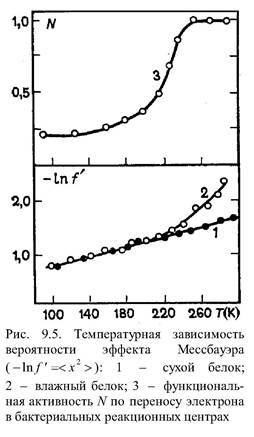
Увеличение вязкости среды приводит к росту тс т. е. к уменьшению скорости диффузии. Отсюда можно понять влияние температуры на внутримолекулярное движение в белке и зависимость среднеквадратичного смещения мессбауэровского атома от температуры. .
При низких температурах тс очень велико, и при поглощении у- кванта мессбауэровское ядро не успевает сместиться за время пребывания в возбужденном состоянии. В этом случае происходит поглощение у- кванта без отдачи (f' ~ 1). В области высоких температур, где ню и тс малы, ядро успевает сместиться и f' падает. Таким образом, при повышении температуры в точке излома температурной кривой изменяется величина тс, которая становится ниже критического значения. По температурной зависимости f' (Т) можно найти величины микровязкости ню для белков, энергии активации (эпсилон) вязкого течения, амплитуды конформационных движений. Имеющиеся в структуре белка альфа- и бета-элементы испытывают ограниченное диффузионное движение, зависящее от жесткости, микровязкости среды. Изгибные флуктуации альфа-спиралей имеют определенную форму, причем амплитуда и время релаксации резко зависят от линейных размеров спирали. В реальных условиях амплитуды изгибных флуктуаций могут достигать нескольких ангстрем, а времена релаксации лежат в микросекундном диапазоне.
Наиболее быстрые и мелкомасштабные флуктуации присущи боковым группам. Эти группы образуют жидкоподобную опушку вокруг спиральных участков полипептидного каркаса и играют роль демпфирующей среды. Иерархия во временах релаксаций позволяет представить динамику белковой глобулы как флуктуации в жидкоподобной капле, армированной упругим полипептидным каркасом. Диффузия лигандов внутри глобулы происходит лишь при образовании флуктуационных полостей или "дырок". Появление "дырки" внутри глобулы может быть инициировано образованием ее вначале в растворителе на поверхности глобулы. Вероятность этого процесса обратно пропорциональна вязкости растворителя. За счет конформационных движений поверхностная группа белка заполняет "дырку" в растворителе. "дырка" теперь оказывается уже в наружном слое белка. Далее, за счет движений групп второго и третьих слоев "дырка" диффундирует внутрь глобулы, обеспечивая появление дополнительных флуктуационных полостей. Форма этих полостей в белке непроизвольна, а имеет вид флуктуирующих щелей, параметры которых определяются геометрией жестких элементов белкового каркаса. Решение диффузионных уравнений позволяет вычислить скорость диффузии частиц через систему таких флуктуирующих щелей. Так, при диффузии в миоглобине лиганд СО должен пройти несколько "ворот", которые открываются за счет конформационных движений. Скорость диффузии зависит от диаметра лиганда, амплитуды флуктуации и времени релаксации щели, которая определяется жесткостью и микровязкостью стенок. Общее время прохождения СО в миоглобине составляет 10-7 с и соответствует сложению времен конформационных релаксаций нескольких ворот в глобуле. В жесткой молекуле белка, где отсутствуют внутримолекулярные движения и структурные флуктуации, диффузия лиганда должна быть сопряжена с преодолением больших активационных барьеров (до 100 ккал/моль). Эти барьеры настолько замедлят движение лиганда, что оно практически станет бесконечно медленным в масштабах биологического времени. В реальных биополимерах с плотной упаковкой именно структурные флуктуации делают возможным перенос лигандов внутри молекулы, что важно для ее функциональной активности.
Дата добавления: 2016-04-11; просмотров: 1877;
