Гомеопатические механизмы.
К физико-химическим механизмам кислотно-щелочного гомеоста-зиса относятся буферные системы внутренней среды организма и тканевые гомеостатические обменные процессы.
Буферные системы внутренней среды организма.Основными буферными системами внутриклеточной, межклеточной жидкости и крови являются • бикарбонатная, - фосфатная и белковая буферная система, причем из последней для крови особо выделяют гемоглобин овый буфер.
Наибольшее значение для поддержания рН межклеточной жидкости и плазмы крови имеет бикарбонатная буферная система. Угольная кислота в плазме и межклеточной жидкости присутствует в четырех формах: физически растворенного углекислого газа (СО2), угольной кислоты (Н2СО,), аниона карбоната (СО32-) и аниона бикарбоната (НСО3). В условиях физиологического диапазона рН больше всего содержание бикарбоната, примерно в 20 раз меньше содержание растворенного углекислого газа и угольной кислоты, а ион карбоната практически отсутствует. Бикарбонат представлен в виде натриевых и калиевых солей. Как уже указывалось выше, константа диссоциации (К) есть отношение:
532
 | |||
 |
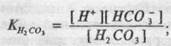
|
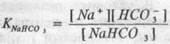
|
а для бикарбоната

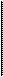

 Анион НСО3 является общим как для кислоты, так и для соли, а соль диссоциирует сильнее, поэтому этот анион, образуясь из бикарбоната, будет подавлять диссоциацию угольной кислоты, т.е. практически все количество аниона НСО3 в бикарбонатном буфере происходит из NaHCO3. Следовательно:
Анион НСО3 является общим как для кислоты, так и для соли, а соль диссоциирует сильнее, поэтому этот анион, образуясь из бикарбоната, будет подавлять диссоциацию угольной кислоты, т.е. практически все количество аниона НСО3 в бикарбонатном буфере происходит из NaHCO3. Следовательно:
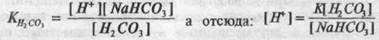
(формула Гендерсона, где К — константа диссоциации угольной кислоты). В связи с использованием отрицательного логарифма концентрации, формула, названная уравнением Гендерсона-Гассгльбаха, для бикарбонатного буфера приняла выражение:
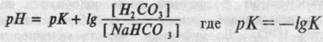
При физиологических значениях рН отношение концентрации углекислоты к бикарбонату составляет 1/20 (рис.13.1).
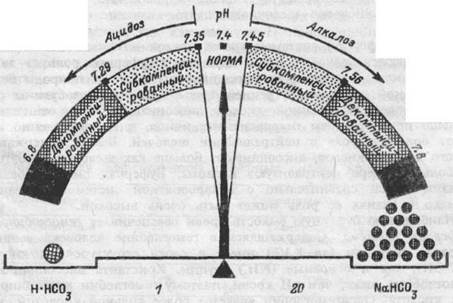
Рис.13.1. Кислотно-щелочное состояние.
Весы изображают соотношение кислота/основание или дыхательная/недыхательная компоненты уравнения Гендерсона-Гассельбаха в норме (1/20) и его сдвиги, ведущие к смещению в сторону алкалоза или ацидоза.
 533
533


 В условиях взаимодействия бикарбонатного буфера с кислотами происходит их нейтрализация с образованием слабой угольной кислоты. Углекислый газ, появляющийся при ее разложении, удаляется через легкие. Избыток оснований, взаимодействуя с бикарбонатным буфером, связывается с угольной кислотой и приводит в конченом счете к образованию бикарбоната, излишки которого удаляются, в свою очередь, из .крови через почки.
В условиях взаимодействия бикарбонатного буфера с кислотами происходит их нейтрализация с образованием слабой угольной кислоты. Углекислый газ, появляющийся при ее разложении, удаляется через легкие. Избыток оснований, взаимодействуя с бикарбонатным буфером, связывается с угольной кислотой и приводит в конченом счете к образованию бикарбоната, излишки которого удаляются, в свою очередь, из .крови через почки.
Другой буферной системой плазмы крови является фосфатная буферная система. Она образована одно- и двузамещенными слоями фосфорной кислоты, где однозамещенные соли являются слабыми кислотами, а двузамещенные — имеют заметные щелочные свойства. Уравнение для фосфатного буфера следующее:
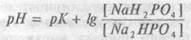
Двухосновной фосфатной соли содержится в плазме в 4 раза больше, чем кислой одноосновной. Общим анионом в этой системе является НРО4. Ее буферная емкость меньше, чем бикарбонатной, т.к. и фосфатов в крови содержится меньше, чем бикарбонатов. Принцип действия фосфатного буфера аналогичен бикарбонатному, хотя роль его в крови мала и, в основном, сводится к поддержанию концентрации бикарбоната при реакции буфера с избытком угольнойкислоты. В то же время в клетках и, особенно, при почечной компенсации кислотно-щелочного сдвига, значение фосфатного буфера велико.
Третьей буферной системой крови, клеток и межклеточной жидкости являются белковая. Белки выполняют буферную роль из-за их амфотерности, а характер их диссоциации зависит от природы белка и актуальной реакции внутренней среды. При этом глобулины обладают более выраженной кислой диссоциацией, т.е. отщепляют больше протонов, чем гидроксильных ионов, и соответственно играют большую роль в нейтрализации щелочей. Белки, содержащие много диаминокислот, диссоциируют больше как щелочи, и поэтому в большей мере нейтрализуют кислоты.Буферная емкость белков плазмы крови сравнительно с бикарбонатной системой невелика, однако в тканях ее роль может быть очень высокой.
Наибольшую буферную емкость крови обеспечивает гемоглобиновая буферная система. Содержащаяся, в гемоглобине человека аминокислота гистидин (до 8,1%) имеет в своей структуре как кислые (СООН), так и основные (NH2) группы. Константа диссоциации у гемоглобина ниже, чем рН крови, поэтому гемоглобин диссоциирует как кислота. Оксигемоглобин является более сильной кислотой, чем редуцированный гемоглобин. При диссоциации оксигемоглобина в капиллярах тканей с отдачей кислорода появляется большее количество щелочно- реагирующих солей гемоглобина, способных связывать Н-ионы, поступающие из кислот тканевой жидкости, например, угольной кислоты. Оксигемоглобин обычно представляет собой калиевую соль. При взаимодействии кислот с калиевой солью оксигемоглобина образуется соответствующая калиевая соль кислоты и
534




 свободный гемоглобин со свойствами очень слабой кислоты. Гемоглобин в тканевых капиллярах связывает углекислый газ за счет аминогрупп, образуя карбгемоглобин:
свободный гемоглобин со свойствами очень слабой кислоты. Гемоглобин в тканевых капиллярах связывает углекислый газ за счет аминогрупп, образуя карбгемоглобин:
НВ- NH2+CO2 —»НВ- NHCOOH.
Для кислотно-щелочного гомеостазиса важное значение имеет также обмен анионов СГ и НСО3 между плазмой и эритроцитами. Если в плазме крови увеличивается концентрация углекислоты, то образующийся при диссоциации NaCl анион СГ входит в эритроциты, где образует КС1, а ион Na+, для которого мембрана эритроцита непроницаема соединяется с избытком НСО3 , образуя бикарбонат натрия, восполняя его убыль в бикарбонатном буфере. При снижении концентрации углекислоты в бикарбонатном буфере происходит обратный процесс — анионы С1 выходят из эритроцитов и соединяются с избытком Na+, освободившимся из бикарбоната, этим следовательно предотвращается ощелачивание плазмы.
Буферные системы плазмы крови и эритроцитов имеют разную относительную эффективность. Так, эффективность буферных систем эритроцитов выше (за счет гемоглобинового буфера), чем плазмы крови (табл. 13.2).
Известно уменьшение концентрации Н-ионов в направлении клетка — межклеточная среда — кровь. Это свидетельствует о том, что наибольшую буферную емкость имеет кровь, а наименьшую внутриклеточная среда. Образуемые в клетках при метаболизме кислоты поступают в межклеточную жидкость тем легче, чем больше их образуется в клетках, так как избыток Н-ионов повышает проницаемость клеточной мембраны. В буферных свойствах межклеточной среды играет роль соединительная ткань, особенно коллагеновые волокна, известные как "ацидофильные". На минимальное накопление кислот они реагируют набуханием, поглощая очень быстро кислоту и освобождая от Н-ионов межклеточную жидкость. Эта способность коллагена объясняется свойством абсорбции.
Таблица 13.2.
Относительная эффективность буферных систем крови
| Плазма крови | % | Эритроциты | % |
| Бикарбонатный Белковый Фосфатный | 35 7 1 | Гемоглобиновый Бикарбонатный Фосфатный | 35 18 4 |
| Общая: | 43% | Общая: | 57% |
Тканевые гомеостатические обменные процессы.Кислотно-щелочное состояние поддерживается в пределах физиологических значений рН и путем метаболических превращений в тканях. Это достигается за счет совокупности биохимических и физико-химических процессов, которые обеспечивают: 1) потерю кислотных и щелочных свойств продуктов обмена веществ, 2) их связывание в средах, препятствующих диссоциации, 3)
 образование новых, более легко нейтрализуемых и выводимых из организма соединений.
образование новых, более легко нейтрализуемых и выводимых из организма соединений.
Так, например, органические кислоты могут соединяться с продуктами белкового обмена (бензойная кислота с глицином) и тем самым терять кислые свойства. Избыток молочной кислоты ресин-тезируется в гликоген, кетоновых тел — в высшие жирные кислоты и жиры. Неорганические кислоты нейтрализуются солями калия, натрия, освобождающимися при дезаминировании аминокислот, аммиаком, образующим аммонийные соли. В опытах на собаках с удаленными почками (для исключения их роли) показано, что после внутривенного введения кислоты 43% ее количества нейтрализуется бикарбонатом плазмы крови, 36% нейтрализуются за счет клеточного натрия, а 15% — за счет выходящего из клеток калия. Основания нейтрализуются преимущественно молочной кислотой, образуемой из гликогена при ощелачивании микроокружения клеток.
В поддержании внутриклеточного рН играет роль обмен производных имидазола и его изомера пиразола. Особенности пя-тичленного кольца этих соединений определяют их амфотерные свойства, т.е. способность быть одновременно и донатором, и акцептором протонов. Имизадол способен очень быстро образовывать соли с сильными кислотами и щелочными металлами. Наиболее распространенным соединением имидазола является а-аминокислота гистидин, участвующая в кислотном и основном катализе.
Сильные кислоты и щелочи могут растворяться в липидах, обладающих низкой диэлектрической константой, что препятствует их диссоциации. Наконец, органические кислоты могуг подвергаться окислению с образованием летучей слабой угольной кислоты.
Дата добавления: 2016-03-27; просмотров: 713;
