ИОННЫЙ МЕХАНИЗМ ВОЗНИКНОВЕНИЯ ПОТЕНЦИАЛА ДЕЙСТВИЯ
В основе потенциала действия лежат последовательно развивающиеся во времени изменения ионной проницаемости клеточной мембраны.
Как отмечалось, в состоянии покоя проницаемость мембраны для калия превышает ее проницаемость для натрия. Вследствие этого поток К'+ из цитоплазмы во внешний раствор превышает противоположно направленный поток Na+ Поэтому наружная сторона мембраны в покое имеет положительный потенциал по отношению к внутренней.
При действии на клетку раздражителя проницаемость мембраны для Na+ резко повышается и в конечном итоге становится примерно в 20 раз больше проницаемости для К'+. Поэтому поток Na+ из внешнего раствора в цитоплазму начинает превышать
|
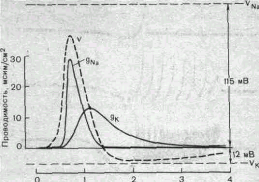
| Время, мс Рис. 6. Временной ход изменений натриевой (gNa) и калиевой (gk) проницаемости мембраны гигантского аксона кальмара во время генерации потенциала действия (V). |
направленный наружу калиевый ток. Это приводит к изменению знака (реверсии) мембранного потенциала: внутреннее содержимое клетки становится заряженным положительно по отношению к ее наружной поверхности. Указанное изменение мембранного потенциала соответствует восходящей фазе потенциала действия (фаза деполяризации).
Повышение проницаемости мембраны для Na+ продолжается лишь очень короткое время. Вслед за этим проницаемость мембраны для Na+ вновь понижается, а для К+ возрастает.
Процесс, ведущий к понижению ранее увеличенной натриевой проницаемости мембраны, назван натриевой инактивацией. В результате инактивации поток Na+ внутрь цитоплазмы резко ослабляется. Увеличение же калиевой проницаемости вызывает усиление потока К+ из цитоплазмы во внешний раствор. В итоге этих двух процессов и происходит реполяризация мембраны: внутреннее содержимое клетки вновь приобретает отрицательный заряд по отношению к наружному раствору. Этому изменению потенциала соответствует нисходящая фаза потенциала действия (фаза реполяризации).
Одним из важных аргументов в пользу натриевой теории происхождения потенциалов действия был факт тесной зависимости его амплитуды от концентрации Na+ во внешнем растворе. Опыты на гигантских нервных волокнах, перфузируемых изнутри солевыми растворами, позволили получить прямое подтверждение правильности натриевой теории. Установлено, что при замене аксоплазмы солевым раствором, богатым К+, мембрана волокна не только удерживает нормальный потенциал покоя, но в течение длительного времени сохраняет способность генерировать сотни тысяч потенциалов действия нормальной амплитуды. Если же К+ во внутриклеточном растворе частично заменить на Na+ и тем самым снизить градиент концентрации Nа+ между наружной средой и внутренним раствором, амплитуда потенциала действия резко понижается. При полной замене К+ на Na+ волокно утрачивает способность генерировать потенциалы действия.
Эти опыты не оставляют сомнения в том, что поверхностная мембрана действительно является местом возникновения потенциала как в покое, так и при возбуждении. Становится очевидным, что разность концентраций Nа+ и К+ внутри и вне волокна является источником электродвижущей силы, обусловливающей возникновение потенциала покоя и потенциала действия.
На рис. 6 показаны изменения натриевой и калиевой проницаемости мембраны во время генерации потенциала действия в гигантском аксоне кальмара. Аналогичные отношения имеют место в других нервных волокнах, телах нервных клеток, а также в скелетных мышечных волокнах позвоночных животных. В скелетных мышцах ракообразных животных и гладких мышцах позвоночных в генезе восходящей фазы потенциала действия ведущую роль играют ионы Са2+. В клетках миокарда начальный подъем потенциала действия связан с повышением проницаемости мембраны для Nа+, а плато потенциала действия обусловлено повышением проницаемости мембраны и для ионов Са2+
О ПРИРОДЕ ИОННОЙ ПРОНИЦАЕМОСТИ МЕМБРАНЫ. ИОННЫЕ КАНАЛЫ
В основе рассмотренных изменений ионной проницаемости мембраны при генерации потенциала действия лежат процессы открывания и закрывания специализированных ионных каналов в мембране, обладающих двумя важнейшими свойствами: 1) избирательностью (селективностью) по отношению к определенным ионам; 2) электровозбудимостью, т. е. способностью открываться и закрываться в ответ на изменения мембранного потенциала. Процесс открывания и закрывания канала имеет вероятностный характер (мембранный потенциал лишь определяет вероятность нахождения канала в открытом или закрытом состоянии).
Так же как ионные насосы, ионные каналы образованы макромолекулами белков, пронизывающими липидный бислой мембраны. Химическая структура этих макромолекул еще на расшифрована, поэтому представления о функциональной организации каналов строятся пока главным образом косвенно — на основании анализа данных, полученных при исследованиях электрических явлений в мембранах и влияния на каналы различных химических агентов (токсинов, ферментов, лекарственных веществ и т. д.). Принято считать, что ионный канал состоит из собственно транспортной системы и так называемого воротного механизма («ворот»), управляемого электрическим полем мембраны. «Ворота» могут находиться в двух положениях: они полностью закрыты или полностью открыты, поэтому проводимость одиночного открытого канала — постоянная величина. Суммарная проводимость мембраны для того или иного иона определяется числом одновременно открытых каналов, проницаемых для данного иона.
Это положение может быть записано следующим образом:
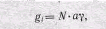
где gi — суммарная проницаемость мембраны для внутриклеточного иона; N — общее число соответствующих ионных каналов (в данном участке мембраны); а—доля открытых каналов; у— проводимость одиночного канала.
По своей селективности электровозбудимые ионные каналы нервных и мышечных клеток подразделяются на натриевые, калиевые, кальциевые, хлорные. Селективность эта не абсолютная:
название канала указывает лишь ион, для которого данный канал наиболее проницаем.
Через открытые каналы ионы движутся по концентрационному и электрическому градиентам. Эти потоки ионов приводят к изменениям мембранного потенциала, что в свою очередь изменяет среднее число открытых каналов и соответственно величину ионных токов и т. д. Такая круговая связь важна для генерации потенциала действия, но она делает невозможным количественную оценку зависимости ионных проводимостей от величины генерируемого потенциала. Для изучения этой зависимости применяется «метод фиксации потенциала». Сущность данного метода состоит в насильственном поддержании мембранного потенциала на любом заданном уровне. Так, подавая на мембрану ток, равный по величине, но обратный по знаку ионному току, проходящему через открытые каналы, и измеряя этот ток при различных потенциалах, исследователи получают возможность проследить зависимость потенциала от ионных проводимостей мем
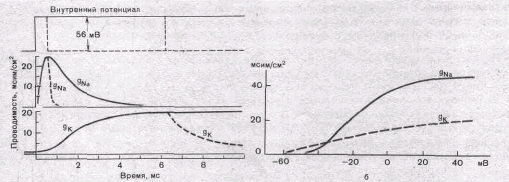
Рис. 7. Временной ход изменений натриевой (§ма) и калиевой (g^) проницаемости мембраны при деполяризации мембраны аксона на 56 мВ.
а — сплошные линии показывают проницаемость при длительной деполяризации, а пунктирные — при репо-ляризации мембраны через 0,6 и 6,3 мс; б — зависимость пиковой величины натриевой (gNa) и стационарного уровня калиевой (gx) проницаемости от мембранного потенциала.
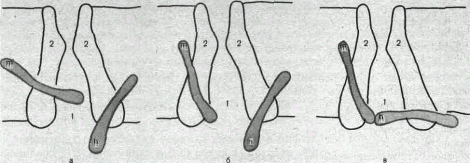
Рис. 8. Схематическое изображение электровозбудимого натриевого канала.
Канал (1) образован макромолекулой белка 2), суженная часть которого соответствует «селективному фильтру». В канале имеются активационные (т) и инактивационные (h) «ворота», которые управляются электрическим полем мембраны. При потенциале покоя (а) наиболее вероятным является положение «закрыто» для активационных ворот и положение «открыто» для инактивационных. Деполяризация мембраны (б) приводит к быстрому открыванию т-«ворот» и медленному закрыванию п-«ворот», поэтому в начальный момент деполяризации обе пары «ворот» оказываются открытыми и через канал могут двигаться ионы в соответствии с их концентрационными и электрическими градиентами. При продолжающейся деполяризации (о) инактивационные «ворота» закрываются и канал переходит в состояние инактивицин.
браны. Чтобы из общего ионного тока, протекающего через мембрану, выделить его компоненты, соответствующие потокам ионов, например, через натриевые каналы, используют химические агенты, специфически блокирующие все другие каналы. Соответственным образом поступают при измерениях калиевого или кальциевого токов.
На рис. 7 показаны изменения натриевой (gNa) и калиевой (gk) проницаемости мембраны нервного волокна во время фиксированной деполяризации. Как отмечалось, величины gNa и gK отражают число одновременно открытых натриевых или калиевых каналов. Как видно, gNa быстро, за доли миллисекунды, достигла максимума, а затем медленно начала снижаться до исходного уровня. После окончания деполяризации способность натриевых каналов вновь открываться постепенно восстанавливается в течение десятков миллисекунд.
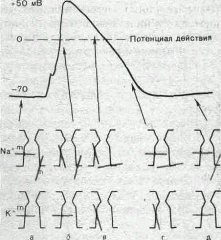 Рис. 9. Состояние натриевых и калиевых каналов в различные фазы потенциалов действия (схема). Объяснение в тексте.
Рис. 9. Состояние натриевых и калиевых каналов в различные фазы потенциалов действия (схема). Объяснение в тексте.
|
Для объяснения такого поведения натриевых каналов высказано предположение о существовании в каждом канале двух типов «ворот» — быстрых активационных и медленных инактивационных. Как следует из названия, начальный подъем gNa связан с открыванием активационных ворот («процесс активации»), последующее падение gNa, во время продолжающейся деполяризации мембраны, — с закрыванием инактивационных ворот («процесс инактивации»).
На рис. 8, 9 схематически изображена организация натриевого канала, облегчающая понимание его функций. Канал имеет наружное и внутреннее расширения («устья») и короткий суженный участок, так называемый селективный фильтр, в котором происходит «отбор» катионов по их размеру и свойствам. Судя по размеру наибольшего проникающего через натриевый канал катиона, отверстие фильтра не меньше 0,3—0,5 нм. При прохождении через фильтр ионы Na+ теряют часть, своей гидратной оболочки. Активационные (m) и инактивационные (h) «ворота» расположены в области внутреннего конца натриевого канала, причем «ворота» h обращены в сторону цитоплазмы. К такому заключению пришли на основании того факта, что приложение некоторых протеолитических ферментов (проназы) к внутренней стороне мембраны приводит к устранению натриевой инактивации (разрушает h-«ворота»),
В состоянии покоя «ворота» т закрыты, тогда как «ворота» h открыты. При деполяризации в начальный момент «ворота» т и h открыты — канал находится в проводящем состоянии. Затем инактивационные ворота закрываются — канал инактивируется. После окончания деполяризации «ворота» h медленно открываются, а «ворота» т быстро закрываются и канал возвращается в исходное покоящееся состояние.
Специфическим блокатором натриевых каналов является тетродотоксин,— соединение, синтезируемое в тканях некоторых видов рыб и саламандр. Это соединение входит в наружное устье канала, связывается с какими-то пока неидентифицированными химическими группами и «закупоривает» канал. Используя радиоактивно меченный тетродотоксин, подсчитали плотность натриевых каналов в мембране. У различных клеток эта плотность варьирует от десятков до десятков тысяч натриевых каналов на квадратный микрон мембраны.
Функциональная организация калиевых каналов сходна с таковой натриевых каналов, различия лишь в их селективности и кинетике процессов активации и инактивации. Селективность калиевых каналов выше селективности натриевых: для Na4' калиевые каналы практически непроницаемы; диаметр их селективного фильтра около 0,3 нм. Активация калиевых каналов имеет примерно на порядок более медленную кинетику, чем активация натриевых каналов (см. рис. 7). На протяжении 10 мс деполяризации gK, не обнаруживает тенденции к инактивации: калиевая инактивация развивается только при многосекундной деполяризации мембраны.
Следует подчеркнуть, что такие соотношения между процессами активации и инактивации калиевых каналов характерны только для нервных волокон. В мембране многих нервных и мышечных клеток существуют калиевые каналы, которые сравнительно быстро инактивируются. Обнаружены также быстро активирующиеся калиевые каналы. Наконец, существуют калиевые каналы, которые активируются не мембранным потенциалом, а внутриклеточным Са2+.
Калиевые каналы блокируются органическим катионом тетраэтиламмонием, а также аминопиридинами.
Кальциевые каналы характеризуются медленной кинетикой процессов активации (миллисекунды) и инактивации (десятки и сотни миллисекунд). Их селективность определяется наличием в области наружного устья каких-то химических групп, обладающих повышенным сродством к двухвалентным катионам: Са2+ связывается с этими группами и только после этого проходит в полость канала. Для некоторых двухвалентных катионов сродство к указанным группам настолько велико, что, связываясь с ними, они блокируют движение Са2+ через канал. Так действует Mn2+. Кальциевые каналы могут быть блокированы также некоторыми органическими соединениями (верапамил, нифедипин), используемыми в клинической практике для подавления повышенной электрической активности гладких мышц.
Характерная особенность кальциевых каналов — их зависимость от метаболизма и, в частности, от циклических нуклеотидов (цАМФ и цГМФ), регулирующих процессы фосфорилирования и дефосфорилирования белков кальциевых каналов.
Скорость процессов активации и инактивации всех ионных каналов увеличивается с возрастанием деполяризации мембраны; соответственно увеличивается до некоторой предельной величины число одновременно открытых каналов.
МЕХАНИЗМЫ ИЗМЕНЕНИЯ ИОННОЙ ПРОВОДИМОСТИ ВО ВРЕМЯ ГЕНЕРАЦИИ ПОТЕНЦИАЛА ДЕЙСТВИЯ
Известно, что восходящая фаза потенциала действия связана с повышением натриевой проницаемости. Процесс повышения gNa развивается следующим образом.
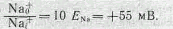
|
В ответ на начальную деполяризацию мембраны, вызванную раздражителем, открывается лишь небольшое число натриевых каналов. Их открывание, однако, приводит к возникновению входящего внутрь клетки потока ионов Na+ (входящий натриевый ток), который увеличивает начальную деполяризацию. Это ведет к открыванию новых натриевых каналов, т. е. к дальнейшему повышению gNa соответственно входящего натриевого тока, а следовательно, к дальнейшей деполяризации мембраны, что, в свою очередь, обусловливает еще большее повышение gNa и т. д. Такой круговой лавинообразный процесс получил название регенеративной (т. е. самообновляющейся) деполяризации. Схематически он может быть изображен следующим образом:
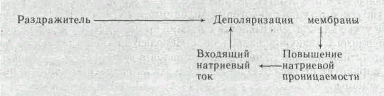
Теоретически регенеративная деполяризация должна была бы завершаться повышением внутреннего потенциала клетки до величины равновесного нернстовского потенциала для ионов Na+:
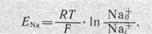
где Nao+— наружная, a Nai+ — внутренняя концентрация ионов Na+
При наблюдаемом соотношение
Эта величина является предельной для потенциала действия. В действительности, однако, пиковый потенциал никогда не достигает величины ЕNa, во-первых, потому, что мембрана в момент пика потенциала действия проницаема не только для ионов Na+, но и для ионов K+ (в значительно меньшей степени). Во-вторых, подъему потенциала действия до величины ЕNa противодействуют восстановительные процессы, ведущие к восстановлению исходной поляризации (реполяризация мембраны).
Такими процессами являются снижение значения gNa и повышение уровня gK
Снижение gNa обусловлено тем, что активация натриевых каналов во время деполяризации сменяется их инактивацией; это приводит к быстрому уменьшению числа открытых натриевых каналов. Одновременно под влиянием деполяризации начинается медленная активация калиевых каналов, обусловливающая рост значения gK. Следствием увеличения gK является усиление выходящего из клетки потока ионов K+ (выходящий калиевый ток).
В условиях понижения gNa, связанного с инактивацией натриевых каналов, выходящий ток ионов K+ приводит к реполяризации мембраны или даже к ее временной («следовой») гиперполяризации, как это имеет место, например, в гигантском аксоне кальмара (см. рис. 4).
Реполяризация мембраны в свою очередь ведет к закрыванию калиевых каналов' и, следовательно, ослаблению выходящего калиевого тока. Вместе с тем под влиянием реполяризации происходит медленное устранение натриевой инактивации: открываются инактивационные ворота и натриевые каналы возвращаются в состояние покоя.
На рис. 9 схематически показано состояние натриевых и калиевых каналов в различные фазы развития потенциала действия.
Все агенты, блокирующие натриевые каналы (тетродотоксин, местные анестетики и многие другие препараты), снижают крутизну нарастания и амплитуду потенциала действия и тем в большей степени, чем выше концентрация этих веществ.
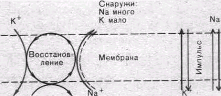 Обмен веществ Внутри:
Na мало К много
Обмен веществ Внутри:
Na мало К много
|
АКТИВАЦИЯ НАТРИЙ-КАЛИЕВОГО НАСОСА ПРИ ВОЗБУЖДЕНИИ
Возникновение серии импульсов в нервном или мышечном волокне сопровождается обогащением протоплазмы Na+ и потерей K+. Для гигантского аксона кальмара диаметром 0,5 мм подсчитано, что во время одиночного нервного импульса через каждый квадратный микрон мембраны в протоплазму поступает около 20 000 Na+ и столько же K+ покидает волокно. В итоге при каждом импульсе аксон теряет около одной миллионной общего содержания калия. Хотя эти потери очень незначительны, при ритмическом следовании импульсов, суммируясь, они должны были бы привести к более или менее заметным изменениям концентрационных градиентов.
Особенно быстро такие концентрационные сдвиги должны были бы развиваться в тонких нервных и мышечных волокнах и мелких нервных клетках, обладающих малым по отношению к поверхности объемом цитоплазмы. Этому, однако, противодействует натриевый насос, активность которого возрастает при повышении внутриклеточной концентрации ионов Na+.
Усиление работы насоса сопровождается значительным повышением интенсивности обменных процессов, поставляющих энергию для активного переноса ионов Na+ и K+ через мембрану. Это проявляется усилением процессов распада и синтеза АТФ и креатин-фосфата, увеличением потребления клеткой кислорода, повышением теплопродукции и т. п.
Благодаря работе насоса нарушенное при возбуждении неравенство концентраций Na+ и K+ по обе стороны мембраны полностью восстанавливается. Следует, однако, подчеркнуть, что скорость выведения Na+ из цитоплазмы с помощью насоса относительно мала: она примерно в 200 раз ниже скорости движения этих ионов через мембрану по концентрационному градиенту.
Таким образом, в живой клетке существует две системы движения ионов через мембрану (рис. 10). Один из них осуществляется по градиенту концентрации ионов и не требует затраты энергии, поэтому его называют пассивным ионным транспортом. Он ответствен за возникновение потенциала покоя и потенциала действия и ведет в конечном итоге к выравниванию концентрации ионов по обе стороны клеточной мембраны. Второй тип движения ионов через мембрану, осуществляющийся против концентрационного градиента, состоит в «выкачивании» ионов натрия из цитоплазмы и «нагнетании» ионов калия внутрь клетки. Этот тип ионного транспорта возможен лишь при условии затраты энергии обмена веществ. Его называют активным ионным транспортом. Он ответствен за поддержание постоянства разности концентраций ионов между цитоплазмой и омывающей клетку жидкостью. Активный транспорт — результат работы натриевого насоса, благодаря которому восстанавливается исходная разность ионных концентраций, нарушающаяся при каждой вспышке возбуждения.
Рис.10. Две системы транспорта ионов через мембрану.
Справа — движение ионов Na+ и K+ по ионным каналам во время возбуждения в соответствии с концентрационным и электрическим градиентами. Слева — активный транспорт ионов против концентрационного градиента за счет энергии метаболизма («натриевый насос»). Активный транспорт обеспечивает поддержание и восстановление ионных градиентов, изменяющихся во время импульсной активности. Пунктирной линией обозначена та часть оттока Na+ которая не исчезает при удалении из наружного раствора ионов K+ [Ходжкин А., 1965].
МЕХАНИЗМ РАЗДРАЖЕНИЯ КЛЕТКИ (ВОЛОКНА) ЭЛЕКТРИЧЕСКИМ ТОКОМ
В естественных условиях генерацию потенциала действия вызывают так называемые местные токи, возникающие между возбужденным (деполяризованным) и покоящимся участками клеточной мембраны. Поэтому электрический ток рассматривается как адекватный раздражитель для возбудимых мембран и успешно используется в экспериментах при изучении закономерностей возникновения потенциалов действия.
Минимальную силу тока, необходимую и достаточную для инициации потенциала действия, называют пороговой, соответственно раздражители большей и меньшей силы обозначают подпороговыми и сверхпороговыми. Пороговая сила тока (пороговый ток) в определенных пределах находится в обратной зависимости от длительности его действия. Существует также некоторая минимальная крутизна нарастания силы тока, ниже которой последний утрачивает способность вызывать потенциал действия.
Существуют два способа подведения тока к тканям для измерения порога раздражения и, следовательно, для определения их возбудимости. При первом способе — внеклеточном — оба электрода располагают на поверхности раздражаемой ткани. Условно принимают, что приложенный ток входит в ткань в области анода и выходит в области катода (рис. 11). Недостаток этого метода измерения порога заключается в значительном ветвлении тока: только часть его проходит через мембраны клеток, часть же ответвляется в межклеточные щели. .Вследствие этого при раздражении приходится применять ток значительно большей силы, чем необходимо для возникновения возбуждения.
При втором способе подведения тока к клеткам — внутриклеточном — микроэлектрод вводят в клетку, а обычный электрод прикладывают к поверхности ткани (рис. 12). В этом случае весь ток проходит через мембрану клетки, что позволяет точно определить наименьшую силу тока, необходимую для возникновения потенциала действия. При таком способе раздражения отведение потенциалов производят с помощью второго внутриклеточного микроэлектрода.
Пороговая сила тока, необходимая для возникновения возбуждения различных клеток при внутриклеточном раздражающем электроде, равна Ю-7— 10-9 А.
В лабораторных условиях и при .проведении некоторых клинических исследований для раздражения нервов и мышц применяют электрические стимулы различной формы: прямоугольной, синусоидальной, линейно и экспоненциально нарастающей, индукционные удары, конденсаторные разряды и т. п.
Механизм раздражающего действия тока при всех видах стимулов в принципе одинаков, однако в наиболее отчетливой форме он выявляется при использовании постоянного тока.
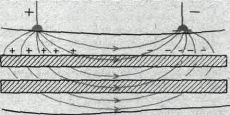
Рис.11. Ветвление тока в ткани при раздражении через наружные (внеклеточные) электроды (схема).
Мышечные волокна заштрихованы, между ними — межклеточные щели.
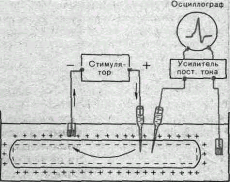
Рис.12. Раздражение и отведение потенциалов через внутриклеточные микроэлектроды. Объяснение в тексте.
ДЕЙСТВИЕ ПОСТОЯННОГО ТОКА НА ВОЗБУДИМЫЕ ТКАНИ
Дата добавления: 2016-03-27; просмотров: 6225;
