Устройство рН—метра. Рабочие измерительные электроды
Принципиальное устройство рН—метра показано на рис. 5.5.
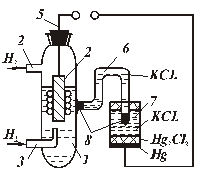
Рис. 5.5. Устройство рН-метра.
В колбу 1 налит испытуемый раствор. Так как необходимо измерять концентрацию ионов водорода, то согласно принципу действия гальванических преобразователей и электрод должен быть выполнен из водорода. Но, поскольку водород является газом и выполнить электрод из него невозможно, пользуются способностью водорода адсорбироваться на поверхности платины. Измерительный (водородный) электрод предcтавляет собой пластинку 2 из черненой платины, которая обтекается непрерывно поступающим через трубку 3 водородом. Водород выходит через отверстие 4. От платиновой пластинки отходит вывод 5 в измерительную цепь.
Для получения второго потенциала колба с испытуемым раствором соединяется через электролитический ключ 6 со вторым образцовым полуэлементом 4. Электролитический ключ представляет собой трубку, закрытую полупроницаемыми пробками 8, и заполненную насыщенным раствором КС1; такое соединение сильно снижает диффузионный потенциал, вносящий погрешность в измерения.
В качестве образцового полуэлемента чаще всего используют каломельный полуэлемент, металлом которого является ртуть, ионы которой получают из раствора каломели Hg2Cl2. Концентрация электролита КС1 определяет потенциал ртути, который равен 0,24 в (при насыщенном растворе КС1).
Кроме каломельного, используются также хлорсеребряный, бромсеребряный и другие образцовые элементы.
Применение водородного электрода в производстве обычно неудобно, так как связано с подачей газообразного водорода. Поэтому на практике большое распространение получил стеклянный электрод (рис. 5.6.).
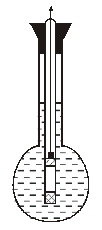
Рис. 5.6. Стеклянный электрод.
Стеклянный электрод представляет собой шаровую тонкостенную колбочку 1, выдуваемую на конце трубки из специальных электропроводных сортов стекла. Толщина стенки-колбочки равна 0,05—0,1 мм.
Колбочка заполняется контрольным (нормальным) раствором какой-либо соли или кислоты с известным рН и погружается в исследуемый раствор.
На границе стекло—раствор появляется определенный потенциал, зависящий от концентрации водородных ионов раствора, в который погружен стеклянный электрод.
При работе используются обе поверхности стеклянного электрода, так как снять потенциал с одной только поверхности невозможно (невозможно включить поверхность стекла в электрическую цепь). Внутрь колбочки 3, заполненной образцовым раствором, вставляется вспомогательный электрод 3 (обычно хлорсеребряный), с которого снимается потенциал стеклянного электрода.
Если в испытуемый раствор поместить каломельный полуэлемент, то э.д.с. на выводах преобразователя будет являться алгебраической суммой э.д.с. хлорсеребряного полуэлемента, внутренней поверхности, наружной поверхности стеклянного электрода И каломельного полуэлемента. Так как при изменении рН исследуемого раствора будет изменяться только потенциал наружной поверхности электрода, а все остальные составляющие э.д.с., останутся неизменными, то измеряя э.д.с. на выводах преобразователя, можно судить о концентрации исследуемого раствора.
Потенциал стеклянного электрода изменяется примерно от 0,3 В (при рН»0) до 0,9 В (при рН»10).
Наиболее обоснованное объяснение действия стеклянного электрода состоит в следующем. При помещении стеклянного электрода в раствор ионы натрия из стекла переходят в раствор, а их места замещают ионы водорода из раствора. В результате этого поверхностный слой стекла оказывается насыщенным водородными ионами, и стеклянный электрод приобретает свойства водородного электрода. Существуют также хингидронный, сурьмяный электроды.. Градуировка рН—метров производится по образцовым буферным растворам, обладающим высокой стабильностью значений рН (±0,01 рН в диапазоне температур от О до 95оС).
Дата добавления: 2016-03-22; просмотров: 858;
