ОБЩИЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
Как уже упоминалось, в ДНК содержится определенная генетическая информация:
-о структуре всех белков и РНК организма,
- а также о порядке реализации этой информации в разных клетках в процессе онтогенеза и при различных функциональных состояниях.
Поскольку во всех соматических клетках организма содержится один и тот же набор хромосом, характерный для данного вида - то, несмотря на подчас сильные отличия между клетками, все они содержат в своих ДНК одну и ту же генетическую информацию. Некоторое исключение составляют лимфоциты, в процессе формирования которых происходит перестройка генов иммуноглобулинов.
Как уже упоминалось в процессе репликации ДНК генетическая информация воспроизводится целиком, чтобы затем передаваться дочерним клеткам.
Но, кроме того, эта информация экспрессируется (реализуется) в клетке, обуславливая все проявления ее жизнедеятельности. Однако экспрессии подвергается отнюдь не вся имеющаяся в ядре генетическая информация, а лишь какая-то (обычно весьма небольшая) ее часть.
Этим и обусловлены особенности тех или иных клеток — тем, каков спектр (набор) функционирующих генов и каковы при этом уровни их активности.
Экспрессия информации о структуре определенного белка включает 2 основных этапа.
Первый из них — транскрипция: образование в клеточном ядре на соответствующем гене (локализующемся в одной из хромосом) специального посредника — матричной РНК (мРНК). Смысл этого процесса — переписывание информации о структуре белка с огромного неподвижного носителя (ДНК в составе хромосомы) на небольшой подвижный носитель —мРНК.
И лишь после того зрелая мРНК в комплексе со специальными белками поступает из ядра в цитоплазму.
Второй из основных этапов экспрессии гена — трансляция: синтез белка на рибосомах по программе, диктуемой мРНК. Суть этой программы — определение очередности, в которой аминокислоты должны включаться в строящуюся пептидную цепь.
Функциональные отделы генома. Гены и их структура
Собственно информация о структуре белков и РНК записана в участках ДНК, называемых генами и цистронами.
Ген — это участок ДНК, кодирующий один белок.
Цистрон — участок ДНК, кодирующий одну полипептидную цепь.
Таким образом, если белок состоит из нескольких разных полипептидных цепей (субъединиц), то его ген включает несколько цистронов (рис. 5.1).
Однако такое подразделение относится, в основном, к бактериям, где цистроны одного гена обычно следуют на ДНК друг за другом.
У животных и человека цистроны нередко располагаются в разных хромосомах и обычно тоже называются генами: например, ген a-цепи и ген b-цепи гемоглобина.
Кроме генов всех белков организма, в хромосомах имеются также гены РНК — четырех видов рибосомных РНК и нескольких десятков транспортных РНК.
Общая совокупность генов, определяющих наследственную информацию организма, называется геномом.
Всего в геноме бактерий (конкретно — кишечной палочки) - около 2500 цистронов. В хромосомах человека число генов, по последним данным, составляет около 30 000.
Почти все гены эукариот (в отличие от генов прокариот) имеют характерную особенность: содержат не только кодирующие участки - экзоны, но и некодирующие - интроны (рис. 5.2).
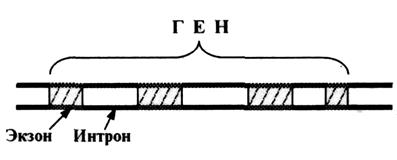
Рис.5.2. Экзоны и интроны в гене
Экзоны и интроны перемежаются друг с другом, что придает гену как бы «разорванную» структуру. Число интронов в гене варьирует от 2 до нескольких десятков; в гене миозина их около 50. Порой на интроны приходится до 90 % общей длины гена.
Возможно, такая организация генов объясняется тем, что в эволюции они образовались из разных фрагментов ДНК (соответствующих теперешним экзонам), которые соединились, хотя и не полностью, в единые функциональные элементы.
Прочие отделы ДНК. Между генами также находятся некодирующие последовательности - спейсеры. Несмотря на общее название, функциональная роль их может быть абсолютно различной.
а) Многие спейсерные участки, видимо, выполняют структурную роль:
· участвуют в правильной укладке нуклеосомной цепи
в высшие структуры хроматина,
· в прикреплении хромосом к аппарату центриолей и т. д.
б) Другие некодирующие участки ДНК служат специфическими локусами связывания определенных белков:
· функционирующих на ДНК ферментов (ДНК-полиме-
разного комплекса и др.),
· белков, выполняющих регуляторную функцию.
При этом участки связывания РНК-полимеразы (фермента, синтезирующего РНК на ДНК) называются промоторами. Они либо вплотную примыкают к началу гена (или группы генов), либо отделены от гена какими-либо другими функциональными локусами.
Характерный компонент промоторов у кишечной палочки — т. н. бокс (последовательность) Прибнова:
в) Что касается участков связывания регуляторных белков, то у бактерий их называют операторами. Они располагаются после промотора (рис. 5.3). При определенных условиях с оператором связывается специфический белок-репрессор, и это блокирует «прочтение» РНК-полимеразой соответствующей группы генов. У эукариот регуляцию «прочтения» генов осуществляют не только белки-репрессоры, но и белки-активаторы — т. н. транскрипционные факторы (рис. 5.3).
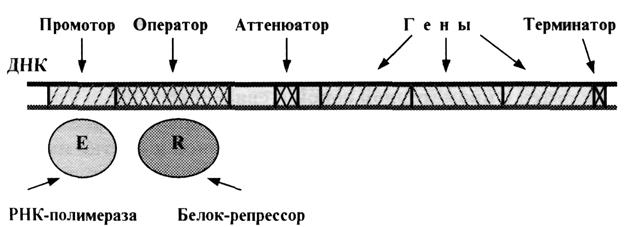
Рис. 5.3. Функциональные отделы в ДНК бактерий
К последним относятся уже упоминавшиеся общие факторы транскрипции, необходимые для связывания РНК-полимеразы с промотором. Эти факторы имеются во всех клетках и необходимы для «прочтения» любого функционирующего гена. Другие транскрипционные факторы повышают активность только определенных генов, и локусы ДНК, связывающие такие факторы, называются энхансерами. Энхансеры могут располагаться достаточно далеко от регулируемого гена: на расстоянии нескольких тысяч нуклеотидных пар. Как же связывание с ними транскрипционных факторов может стимулировать активность гена?
Видимо, дело в сложной пространственной организации ДНК. Последняя образует петли, благодаря чему энхансеры сближаются с промоторной зоной и связанные с ними факторы влияют на активность транскрипционного комплекса (рис.5.4.).
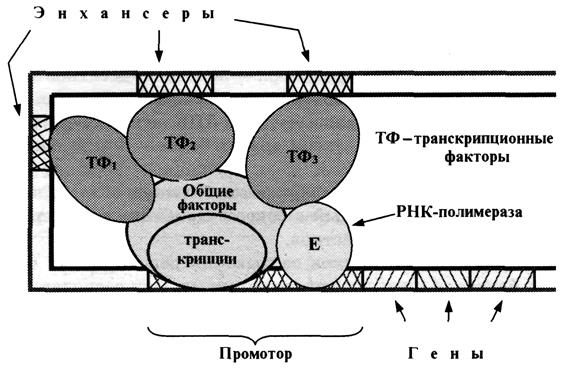
Рис.5.4. Функциональные отделы в ДНК эукариот
Причем, для некоторых ключевых генов в клетке имеется сразу несколько энхансеров, достаточно удаленных друг от друга. Следовательно, все они в результате изгибов ДНК должны собираться примерно в одном месте пространства.
Что же касается белков-репрессоров, то они при вхождении в состав транскрипционных комплексов не повышают, а понижают их активность.
Часто используется также термин «супрессоры» — так называются факторы (обычно это белки), которые угнетают тот или иной клеточный процесс. Например, опухолевые супрессоры — регуляторные белки, препятствующие опухолевому росту. Очевидно, по механизму своего действия они могут быть как репрессорами, так и транскрипционными факторами.
г) В ДНК могут содержаться короткие локусы, служащие сигналами об окончании (терминации) транскрипции ДНК.
У бактерий в ряде случаев участки с такой функцией находятся перед группой совместно регулируемых генов. Это т. н. аттенюаторы (см. рис. 5.3). Терминирующие же участки, располагающиеся после генов, называются терминаторами.
В одних условиях транскрипция прекращается на аттенюаторе (гены не считываются), в других условиях — на терминаторе (гены прочитываются).
У эукариот сигналы терминации более сложные: в отличие от бактериальных, они тоже транскрибируются РНК-полимеразой, и только затем последняя завершает свою работу.
Оперонная организация генетического материала у бактерий. Регулируемые и конститутивные гены
Общая схема оперона
У бактерий гены ферментов, катализирующих ряд последовательных реакций, нередко объединяются в одну структурно-функциональную единицу — оперон (рис. 5.5).
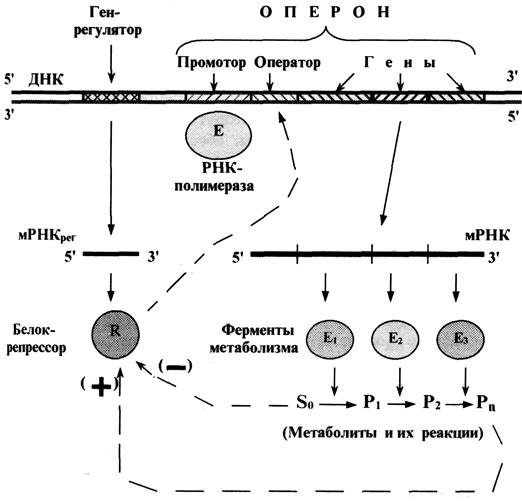
Рис.5.5. Схема функционирования оперона
Помимо указанных генов, в оперон входят промотор (место связывания РНК-полимеразы) и оператор (место связывания белка-репрессора).
Сам же белок-репрессор кодируется специальным геном-регулятором, который в состав оперона обычно не входит. Для разных оперонов существуют разные белки-репрессоры и, соответственно, разные гены-регуляторы. Хотя не исключено, что какие-то белки-репрессоры контролируют активность сразу нескольких оперонов.
Принцип регуляции активности оперона состоит в том, что на сродство белка-репрессора к оператору могут влиять метаболиты той цепи реакций, ферменты которой кодируются данным опероном. В связи с этим различают опероны двух типов.
а) Индуцибельные опероны:
- регулятором является исходный субстрат (So) цепи контролируемых реакций;
- в отсутствие этого субстрата белок-репрессор имеет высокое сродство к оператору, отчего РНК-полимераза не может транскрибировать гены оперона (оперон «выключен»);
- при накоплении метаболита So в клетке некоторое количество его связывается с белком-репрессором, понижая сродство последнего к оператору; оперон «включается» - и синтезируются ферменты, обеспечивающие превращения вещества So.
Как видно, регуляция оперона веществом So — это пример прямой положительной связи: начальный субстрат стимулирует в конечном счете реакции своего метаболизма.
б) Репрессибельные опероны:
- регулятором служит конечный продукт (Рn) цепи контролируемых реакций;
- в отсутствие этого продукта белок-репрессор имеет низкое
сродство к оператору; поэтому РНК-полимераза транскрибирует гены оперона — оперон «включен», и синтезируются ферменты, способствующие образованию вещества Рn;
- при накоплении же данного вещества некоторое его количество связывается с белком-репрессором и повышает сродство последнего к оператору - оперон «выключается», синтез соответствующих ферментов и образование метаболита Рn прекращаются.
Здесь, в отличие от предыдущего случая, мы видим регуляцию по типу отрицательной обратной связи: метаболит тормозит в итоге реакции, ведущие к его образованию.
Таковы общие схемы функционирования индуцибельных и репрессибельных оперонов. Но организация конкретных оперонов нередко включает те или иные дополнительные детали, которые порой существенно усложняют картину.
Конститутивные гены и белки. Подобным образом регулируется активность далеко не всех генов.
Многие гены являются конститутивными, т. е. все время находятся в активном состоянии, и скорость их транскрипции не подвергается избирательной регуляции (хотя и может меняться в связи с изменением общего состояния клетки). Такие гены кодируют белки (в т. ч. ферменты), постоянно необходимые клетке.
Эти белки (как и гены) тоже называются конститутивными. Для кишечной палочки к подобным белкам относятся, например, ферменты метаболизма глюкозы.
Но скорость транскрипции различных конститутивных генов может не совпадать. Этому может быть несколько причин.
а) Одна из них — различное сродство промоторов к РНК-полиме-разе, или, как говорят, различная «сила» промоторов.
У некоторых конститутивных генов промотор имеет высокое сродство к РНК-полимеразе (т. е. является «сильным»). Поэтому здесь молекулы РНК-полимеразы связываются с промотором часто, отчего за единицу времени образуется большое количество копий мРНК.
У промоторов других генов невысокое сродство к РНК-полимеразе. Соответственно, молекулы этого фермента связываются редко, и образуется гораздо меньше копий мРНК.
б) Вторая возможная причина заключается в самой РНК-полимеразе.
В разных условиях существования бактериальной клетки образуются сигма-факторы, узнающие разные промоторы. Так, особые сигма-факторы соответствуют обычным условиям, азотному голоданию, тепловому шоку и состоянию споруляции. В каждом из этих случаев РНК-полимераза связывается с промоторами одних генов и не связывается с промоторами других генов.
Таким образом, у бактерий используются два принципиальных способа регуляции экспрессии генов:
- регуляция связывания РНК-полимеразы с промоторами (за счет природы промотора, природы сигма-фактора РНК-полимеразы, а также, как мы увидим на примере лактозного оперона, специального белка САР);
- регуляция перемещения связавшейся РНК-полимеразы от промотора к собственно генам (при «чисто» опероном механизме регуляции).
Примеры оперонов. Лактозный оперон — пример индуцибельных оперонов. Лактозный оперон интересен тем, что здесь в одной регуляторной системе используются сразу оба только что названных принципиальных подхода — регуляция и связывания РНК-полимеразы, и ее перемещения через оператор.
Причем, существуют и другие опероны со сходным принципом организации. Примечательно, что все они являются индуцибельными и все контролируют распад (катаболизм) поступающих извне питательных веществ. В то же время не для всех таких веществ имеется оперонный принцип регуляции, примером чему, как отмечалось выше, служит глюкоза.
Рассмортим лактозный оперон (рис. 5.6).
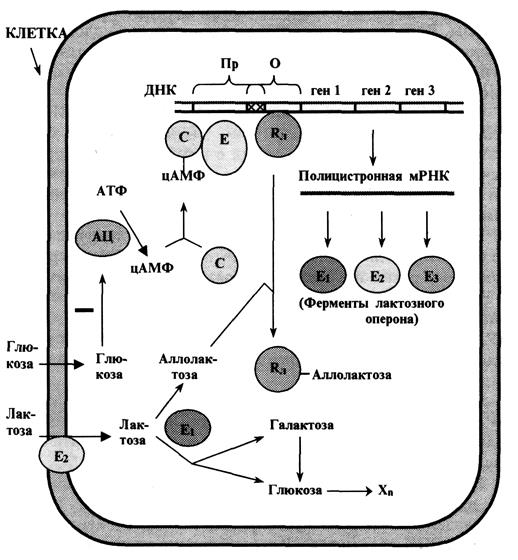
Рис.5.6. Схема лактозного оперона
Пр- промотор, О – оператор, С- САР (белковый активатор катаболизма), Е- РНК-полимераза, Rл – репрессор лактозного оперона, Е1- b-галактозидаза, Е2- пермеаза, Е3- трансацетилаза, АЦ- аденилатциклаза
Он включает три гена. Из них первые два кодируют ферменты утилизации лактозы: пермеазу и b-галактозидазу.
Пермеаза необходима для проникновения лактозы из внешней среды в клетку. Заметим, что даже при «выключенном» опероне имеется небольшое количество пермеазы. Поэтому при появлении во внешней среде лактозы какое-то количество ее может проникать внутрь и оказывать сигнальное воздействие на лактозный оперон.
Второй фермент — b-галактозидаза — катализирует распад лактозы на глюкозу и галактозу. Последние далее вступают в катаболические превращения, обеспечиваемые конститутивными ферментами. При «выключенном» опероне имеется небольшая активность и этого фермента. Это важно потому, что параллельно с основной реакцией (гидролизом лактозы) происходит и побочная — изомеризация лактозы в аллолактозу (где галактоза и глюкоза соединены не 1,4-, а 1,6-гликозидной связью). И именно аллолактоза, а не лактоза, служит регулятором активности оперона.
Конкретно, аллолактоза, появляясь в клетке при наличии во внешней среде лактозы, связывается с лактозным репрессором. Этот белок кодируется специальным геном, имеет 4 субъединицы и в отсутствие аллолактозы связывается с оператором лактозного оперона, блокируя транскрипцию генов оперона. Аллолактоза же, связываясь с репрессором, снижает его сродство к оператору, что деблокирует гены. Таким образом, при появлении вне клетки лактозы происходит активация лактозного оперона и интенсивное образование в клетке ферментов утилизации лактозы.
Но это имеет место только тогда, когда во внешней среде нет глюкозы. Если же там достаточно глюкозы, то биологического смысла в использовании лактозы уже нет. В соответствии с этим, глюкоза препятствует активации лактозного оперона даже в присутствии больших количеств лактозы.
Достигается это путем влияния на связывание РНК-полимеразы с промотором. Дело в том, что промоторная область в лактозном опероне (и в сходных с ним оперонах) шире, чем обычно, и способна связывать не только РНК-полимеразу, но и особый белок — CAP (catabolite gene activator protein), белковый активатор катаболизма.
В отсутствие САР РНК-полимераза очень плохо связывается с промотором лактозного оперона, а САР изменяет структуру промотора, резко повышая его сродство к РНК-полимеразе. По существу, САР играет у бактерий примерно ту же роль, что общие факторы транскрипции у эукариот. Только САР необходим для деятельности лишь некоторых оперонов, тогда как общие факторы транскрипции — для функционирования любого гена эукариот.
Связывание САР с промотором происходит, только если САР находится в комплексе с циклическим АМФ (цАМФ). Последний же образуется из АТФ под влиянием фермента адени-латциклазы.
В отсутствие глюкозы активность аденилатциклазы высокая, в клетке — достаточная концентрация цАМФ, поэтому САР связан с лактозным промотором, к которому легко присоединяется РНК-полимераза. В этих условиях активность оперона зависит только от того, свободен или нет оператор, т. е. от наличия во внешней среде лактозы.
Если же имеется глюкоза, то активность аденилатциклазы оказывается сниженной, отчего в итоге промотор остается без САР и практически теряет сродство к РНК-полимеразе. Лактозный оперон не функционирует, а в качестве питательного субстрата используется глюкоза.
Третий ген оперона кодирует трансацетилазу — фермент, катализирующий in vitro ацетилирование тиогалактозида. Имеет ли трансацетилаза какое-либо отношение к обмену лактозы и почему ее ген находится в лактозном опероне, неясно.
Триптофановый оперон — пример репрессибельных оперонов. В триптофановом опероне, как и в лактозном, тоже имеется двойной механизм регуляции. Во-первых, как обычно, регулируется перемещение РНК-полимеразы по оператору. Вторым же (и более чувствительным) объектом регуляции является не связывание РНК-полимеразы с промотором, а окончание транскрипции на аттенюаторе.
Как правило, опероны, имеющие аттенюатор, являются ре-прессибельными и контролируют синтез (анаболизм) того или иного необходимого компонента — например, редкой аминокислоты: триптофана, гистидина, фенилаланина.
Триптофановый оперон (рис. 5.7) включает 5 цистронов, кодирующих четыре фермента заключительного этапа образования триптофана.
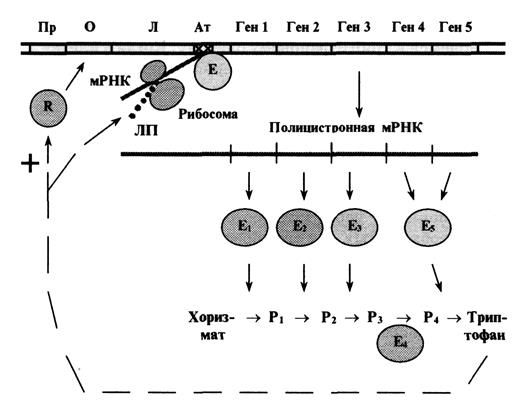
Рис.5.7. Схема триптофанового оперона
Пр-промотор, О- оператор, Л- лидерный отдел оперона, Ат- аттенюатор, R- белок-репрессор, Е- РНК-полимераза, ЛП- лидерный пептид, Е1…Е5 - ферменты синтеза триптофана, Р1…Р4- промежуточные метаболиты пути синтеза триптофана.
При этом последний фермент содержит субъединицы двух видов, отчего кодируется двумя цистронами. Вместе с тем, ген предпоследнего фермента цепочки, по-видимому, находится где-то вне данного оперона.
Вслед за промотором и оператором в оперонах этого типа находится т. н. лидерный отдел; именно он оканчивается аттенюатором.
В процессе транскрипции этого отдела образуется лидерный участок мРНК. Последний тут же связывает рибосому и начинает трансляцию с образованием лидерного пептида (ЛП). Ключевая особенность последнего — среди его 14 аминокислотных остатков содержатся 2 остатка триптофана, т. е. той самой аминокислоты, синтез которой контролируется опероном.
Аналогично, в ЛП фенил ал анинового оперона среди 15 остатков — 7 остатков фенилаланина, а в ЛП гистидинового оперона — 7 подряд остатков гистидина. Так что механизм аттенюаторной регуляции во всех этих случаях одинаков.
Когда в клетке достаточно триптофана, то синтез лидерного пептида идет без задержки: образующая его рибосома не отстает от РНК-полимеразы. В этих условиях при достижении РНК-полимеразой аттенюатора с высокой долей вероятности срабатывает сигнал об окончании транскрипции: РНК-полимераза диссоциирует от ДНК и гены не считываются.
Таким образом, триптофан, быстро включаясь в лидерный пептид, блокирует через аттенюаторный механизм синтез ферментов, необходимых для его образования. Правда, блокирование это — не полное, т. к. сохраняется небольшая вероятность того, что РНК-полимераза все же преодолеет аттенюаторный участок.
Если, наоборот, концентрация триптофана в клетке низкая, то рибосома задерживается с синтезом лидерного пептида и отстает от РНК-полимеразы. Это так меняет конфигурацию ДНК или лидерного отдела мРНК, что сигнал об окончании трансляции на аттенюаторе не срабатывает. Каждая молекула РНК-полимеразы проходит этот «опасный» участок и транскрибирует гены. Т.е. активно синтезируются ферменты, необходимые для пополнения запаса триптофана в клетке.
Содержание триптофана в самих этих ферментах весьма невелико. Поэтому его дефицит в клетке не очень сильно сказывается на скорости трансляции структурных цистронов мРНК (в отличие от синтеза лидерного пептида).
Итак, через аттенюаторный механизм триптофан может подавлять активность «своего» оперона, но, как было сказано, не до конца.
Более глубокое подавление активности оперона происходит при очень высокой концентрации триптофана. Тогда реализуется второй (и более общий) способ регуляции. Триптофан связывается со специфическим белком-репрессором и повышает его сродство к оператору триптофанового оперона. Это полностью блокирует данный оперон.
Дата добавления: 2016-02-09; просмотров: 1153;
