Бензолсульфониламиды и их производные.
Сульфаниламид ( стрептоцид ). Сульфаниламиды, замещённые по амидной группе, производные алифатического и гетероциклического рядов: сульфацетамид-натрий ( Сульфацил-натрий ), сульфаметоксазол + триметоприм ( ко-тримоксазол, Бисептол ), сульфадиметоксин, сульфален. Сульфаниламиды, замещённые по амидной группе и ароматической аминогруппе: фталилсульфаметизол ( Фталазол ), салазопиридазин. Производные амида бензолсульфоновой кислоты: фуросемид, гидрохлоротиазид ( Дихлотиазид, Гипотиазид ), буметанид ( Буфенокс ).
Сульфаниламидные препараты
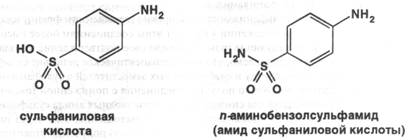 Предшественник этих химических соединений был синтезирован в 1908 году Гельмо. Однако химиотерапевтические свойства были обнаружены только в 1935 году венгром Домагком. Все ныне применяемые препараты являются производными сульфаниловой кислоты, её амида:
Предшественник этих химических соединений был синтезирован в 1908 году Гельмо. Однако химиотерапевтические свойства были обнаружены только в 1935 году венгром Домагком. Все ныне применяемые препараты являются производными сульфаниловой кислоты, её амида:
Структурную формулу сульфаниламидного препарата можно представить схемой:
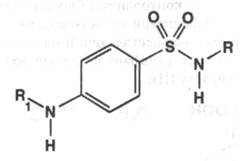
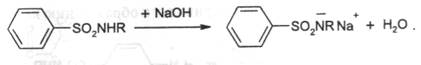
Радикалы на схеме могут быть различны, что и предопределяет большое количество препаратов этой группы. Однако надо отметить, что большинство препаратов является первичными аминами. Если же заменить эту аминогруппу на другие радикалы, то терапевтический эффект пропадает. В таком случае было установлено, что терапевтический эффект сохраняется, если радикал ( заместитель ) в первичной аминогруппе после гидролиза позволяет образовать свободную аминогруппу. Изменение положения аминогруппы, введение в ароматическое кольцо дополнительных радикалов приводит к значительной потере терапевтического эффекта или его отсутствию. Замещение атома водорода в сульфамидной группе позволило получить препараты с меньшей токсичностью и различной активностью. Из-за отрицательного индуктивного эффекта SO2-группы препараты обладают NH-кислотностью и растворяются в щелочах с образованием солей:
Ацилирование сульфамидной группы приводит к образованию имидов, которые обладают ещё большей NH-кислотностью и растворяются даже в карбонатах. Механизм антибактериального действия сульфаниламидов основан на схожести пара-аминобензойной кислоты и препаратов группы. В присутствии сульфаниламидов микробный фермент осуществляет синтез фолиевой кислоты не из пара-аминобензойной кислоты, а из её заместителя. Поэтому получается синтез не фолиевой кислоты, а псевдофолиевой кислоты, при этом образовавшееся соединение не может участвовать в нормальном метаболизме микробной клетки и нарушается синтез белков и нуклеиновых кислот.
Синтез сульфаниламидных препаратов состоит из трёх основных стадий: 1) получение хлорангидрида сульфаниловой кислоты; 2) получение соответствующего аминопроизводного R/-NH2; 3) конденсация хлорангидрида сульфаниловой кислоты с аминопроизводным. Рассмотрим подробнее происходящие процессы.
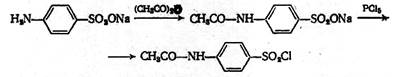
Первая стадия у всех препаратов общая. Ввиду того, что сульфаниловая кислота не может быть непосредственно превращена в хлорангидрид, её предварительно ацилируют ( защищают аминогруппу ) и уже ацетилсульфаниловую кислоту превращают в хлорангидрид:
|
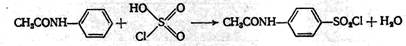
|
Хлорангидрид ацетилсульфаниловой кислоты можно также получить из ацетанилида действием на него хлорсульфоновой кислоты:
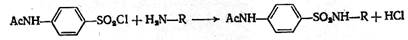
|
Вторая стадия синтеза индивидуальна для каждого препарата и зависит от R. На третьей стадии хлорангидрид ацилсульфаниловой кислоты конденсируют с соответствующим амином:
Реакцию необходимо проводить в слабощелочной среде, чтобы нейтрализовать выделяющуюся хлороводородную кислоту, чтобы она не вступала в реакцию с амином с образованием соли. Ацильную группу омыляют, так как ацилированные препараты не дают терапевтического эффекта. Омыление проводят щёлочью, поэтому получаются натриевые соли. Их обрабатывают кислотой и затем проводят очистку:
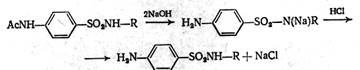
В зависимости от условий синтеза могут получаться таутомеры – амидо- или имидо-формы. Препараты этой группы могут иметь полиморфные модификации, а также быть в виде гидратов или сольватов, что обусловлено технологическим процессом производства и влияет на внешний вид получаемых соединений. Сульфаниламиды проявляют амфотерные свойства. Основные свойства зависят от наличия первичной ароматической аминогруппы. Надо отметить, что в растворах они образуют соли с минеральными кислотами, но соли эти сильно гидролизованы, так как основные свойства проявляются слабо, из-за сопряжения атома азота с ароматическим кольцом. Кислотные свойства выражены сильнее – за счёт наличия группы –SO2-NH-, которая содержит подвижный атом водорода, как упоминалось ранее, из-за отрицательного индуктивного эффекта:
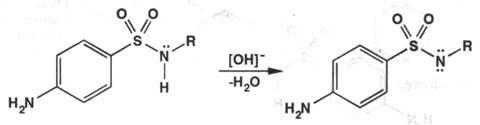
Классификацию сульфаниламидов можно провести двумя способами: 1) по химическому строение. В этом случае их подразделяют на а) препараты, замещённые по амидной группе; б) на препараты, замещённые по амино группе; в) препараты, замещённые по обеим группам; 2) по продолжительности действия ( фармакологическая классификация ). В этом случае их делят на препараты короткого действия, среднедлительного, длительного и сверхдлительного действия.
Испытания на подлинность
Имеются групповые и частные реакции на препараты. Групповые: 1) Реакция образования азокрасителя – общая реакция на первичные ароматические амины. Если аминогруппа замещена, её гидролизуют кипячением с хлороводородной кислотой; 2) Реакции конденсации – образуют продукты конденсации с 2,4-динитрохлорбензолом в щелочной среде и в кислой среде окрашенные продукты конденсации с ванилином (жёлтое), формальдегидом ( розовое или жёлто-оранжевое ), пара-диметиламинобензальдегидом ( жёлтое ); 3) Лигниновая проба – разновидность реакций образования шиффовых оснований; проводится на газетной бумаге или древесине. Первичный ароматический амин взаимодействует с находящимся в составе лигнина сиреневым альдегидом, или ванилином и даёт шиффово основание оранжево-жёлтого цвета; 4) Реакции галогенирования – основаны на активировании бензольного кольца донорской аминогруппой; галогены направляются в орто-положение от аминогруппы (пара-положение уже занято сульфамидной группой). Эти реакции могут использоваться как в качественном, так и количественном анализе; 5) Реакции с растворами солей тяжёлых металлов – некоторые ионы тяжёлых металлов могут замещать атом водорода в сульфамидной группе, и образуют внутрикомплексные соединения; 6) Реакция обнаружения серы – серу можно обнаружить после окисления органической части молекулы концентрированной азотной кислотой ( минерализация ). Далее сульфат-ион обнаруживают реакцией с хлоридом бария; 7) Реакции пиролиза – при термическом разложении в сухой пробирке плавы препаратов приобретают различную окраску, при этом выделяются газообразные продукты; 8) Реакции с нитропруссидом натрия – препараты взаимодействуют с 1% раствором нитропруссида натрия в щелочной среде, а после подкисления реакционной смеси минеральной кислотой дают продукт красно-коричневого цвета, или осадок; 9) Реакции окисления – при этом образуются окрашенные соединения хиноидной структуры (индофенолы). Частные реакции характеризуют строение конкретного препарата по группировкам, входящим в его состав. Например, у натриевых солей препаратов подтверждают наличие иона натрия.
Методы количественного определения
Фармакопея и ФС рекомендуют метод нитритометрии для препаратов. Титрант метода – 0,1 М раствор нитрита натрия; точка эквивалентности устанавливается 1) по внешнему индикатору – йодкрахмальная бумажка; 2) внутренний индикатор – тропеолин 00; смесь тропеолина 00 с метиленовым синим ); 3) потенциометрически.
Метод нейтрализации. Основан на способности сульфаниламидов образовывать соли со щелочами:
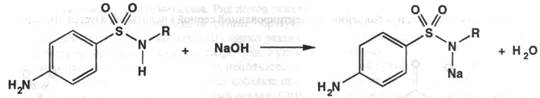
Образующаяся соль тотчас подвергается гидролизу, и результаты определения искажаются. Поэтому препараты с константой диссоциации 10-7-10-8 титруют в водно-ацетоновом растворе или в этаноле при индикаторе тимолфталеин, а с константой диссоциации 10-9 только в неводных растворителях. Натриевые соли сульфаниламидов можно оттитровать минеральной кислотой в спирто-ацетоновой среде с индикатором метиловым оранжевым.
Метод броматометрии. Основан на реакции галогенирования сульфаниламидов. Титрант – раствор бромата калия в присутствии бромида калия в кислой среде. При прямом титровании КТТ устанавливается по обесцвечиванию выделяющимся бромом индикатора – метилового оранжево, а при обратном методе – избыток брома определяется йодометрически:
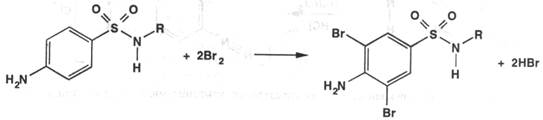 KBrO3 + 5KBr + 6HCl = 3Br2 + 6KCl + 3H2O
KBrO3 + 5KBr + 6HCl = 3Br2 + 6KCl + 3H2O
Br2 + 2KI = I2 + 2KBr
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
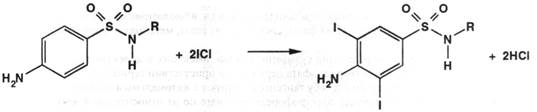
Йодхлорметрия. Метод аналогичен броматометрическому, но йодирование проводят титрованным раствором йодмонохлорида. Его избыток устанавливают йодометрически:
ICl + KI = I2 + KCl
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
 Определение по сульфат-иону методом окисления. Минерализуют препарат нагреванием с 30% пероксидом водорода в присутствии следов хлорида железа (III). Образовавшийся раствор содержит в эквивалентном сульфаниламиду количестве сульфат-ион, который определяется гравиметрически или титриметрически раствором хлорида бария.
Определение по сульфат-иону методом окисления. Минерализуют препарат нагреванием с 30% пероксидом водорода в присутствии следов хлорида железа (III). Образовавшийся раствор содержит в эквивалентном сульфаниламиду количестве сульфат-ион, который определяется гравиметрически или титриметрически раствором хлорида бария.
Streptocidun ( Sulfanilamide ). Стрептоцид ( сульфаниламид ) фармакопейный препарат п-Аминобензолсульфамид
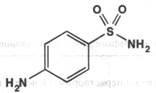
Описание: белый кристаллический порошок без запаха.
Растворимость: мало растворим в воде, легко растворим в кипящей воде, в разведённой хлороводородной кислоте, растворах едких щелочей и ацетоне, трудно растворим в спирте, практически нерастворим в эфире и хлороформе.
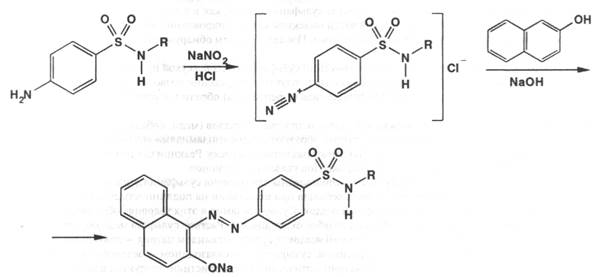 Подлинность: по ГФX 1) препарат даёт характерную реакцию на первичные ароматические амины:
Подлинность: по ГФX 1) препарат даёт характерную реакцию на первичные ароматические амины:
2) 0,1 г препарата нагревают в сухой пробирке на пламени горелки; образуется плав фиолетово-синего цвета и ощущается запах аммиака и анилина ( отличие от других сульфаниламидных препаратов ).
По ФС рекомендовано измерять УФ-спектр 0,0008% раствора в 0,01 М растворе гидроксида натрия в области 210-360 нм; максимум наблюдается при 251 нм. УФ-спектр 0,015% раствора препарата в 1 М растворе хлороводородной кислоты имеет максимумы при 264 и 271, а минимумы при 241 и 268 нм. Также возможно применение ИК-спектроскопии; идентификацию проводят по наличию характеристических полос поглощения, которые должны совпадать с рисунками, прилагаемыми к ФС.
Этому препарату присущи все общие реакции – с солями тяжёлых металлов, бромирование ароматического ядра, определение сульфогруппы минерализацией и так далее. Частные нефармакопейные реакции; 1) на сульфамидную группу – при нагревании со щелочью ощущается запах аммиака:
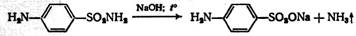 2) при действии окислителей, например перекиси водорода, и затем хлорида железа (III) появляется красно-фиолетовое окрашивание.
2) при действии окислителей, например перекиси водорода, и затем хлорида железа (III) появляется красно-фиолетовое окрашивание.
Чистота:по ФС методом ТСХ на пластинках “Силуфол УФ-254” в сравнении с веществом-свидетелем. Пятно должно быть одно. Устанавливается микробиологическая чистота препарата по ГФXI, в. 2, с. 193.
ГФX требует проверять кислотность.
Допустимые примеси: хлориды, сульфаты, органические примеси, сульфатная зола – в пределах эталона.
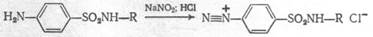
|
Количественное определение: по ГФX – нитритометрия ( стр. 799 ГФX ). Титрант – 0,1 М раствор нитрита натрия. Химизм метода при использовании внешнего индикатора:
Избыточный 2NaNO2 + 2KI + 4HCl = 2NaCl + 2KCl + I2¯ + 2NO + 2H2O
Могут быть использованы другие методы, кроме метода нейтрализации.
Хранение: список Б; в хорошо укупоренной таре.
Применение: для лечения ангины и других кокковых инфекций; внутрь и наружно в виде мази или эмульсии.
Форма выпуска: порошок и таблетки по 0,3 и 0,5 г.
Sulfacylum-natrium ( Sulfacylum solubile, Sulfacetamide Sodium ). Сульфацил-натрий ( Сульфацетамид натрия ) фармакопейный препарат пара-Аминобензолсульфонилацетамид-натрий
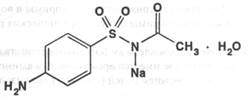
|
Получение: из хлорангидрида карбометоксисульфаниловой кислоты, который амидируют аммиачной водой при лёгком нагревании:
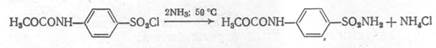
|
Вторая стадия – полученный амид ацетилируют уксусным ангидридом в присутствии катализатора ( сухой пиридин ); полученный продукт подвергают омылению 10% раствором щёлочи:
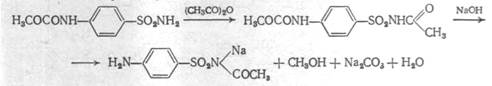
Описание: белый кристаллический порошок без запаха.
Растворимость: легко растворим в воде, практически нерастворим в спирте, эфире, хлороформе и ацетоне.
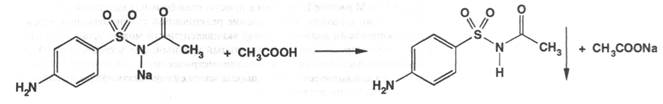
|
Подлинность: по ГФX 1) препарат даёт характерную реакцию на ароматические первичные амины ( см. Стрептоцид ) и 2) реакцию Б на натрий; 3) 0,1 г препарата растворяют в 3 мл воды и приливают 1 мл раствора сульфата меди; образуется осадок голубовато-зеленоватого цвета, который не изменяется при стоянии ( отличие от других сульфаниламидных препаратов ). ФС предлагает снять УФ-спектр 0,001% раствора препарата в воде, он должен иметь максимум поглощения при 256 нм и минимум при 227нм.При действии уксусной кислотой выделяется белый осадок сульфацетамида, который имеет характерную температуру плавления 1830 С:
Чистота: ГФX предлагает проводить определение прозрачности и цветности раствора, щёлочности. По ФС проверяют на потерю в массе при высушивании, методом ТСХ определяют примеси на пластинках “Силуфол УФ-254” в сравнении с веществом-свидетелем. Пятно должно быть одно. Устанавливается микробиологическая чистота препарата по ГФXI, в. 2, с. 193.
Допустимые примеси: хлориды, сульфаты и тяжёлые металлы в пределах эталона.
Количественное определение: по ГФX – нитритометрия. Нефармакопейно – методом нейтрализации как соль сильного основания и слабой кислоты ( титрант – хлороводородная кислота в спирто-ацетоновой среде для предотвращения гидролиза ). Сульфацила-натрия в препарате должно быть не менее 99,0%.
Хранение: список Б; в хорошо укупоренной таре, предохраняющей от действия влаги и света.
Применение: для лечения глазных заболеваний. В.р.д. внутрь – 2,0 г; в.с.д. внутрь 7,0 г
Форма выпуска: порошок, 20; 30% растворы для закапывания в глаз, мази.
Sulfadimethoxinum ( Sulfadimethoxine ). Сульфадиметоксин нефармакопейный препарат
6-( п-Аминобензолсульфамидо )-2,4-диметоксипиримидин
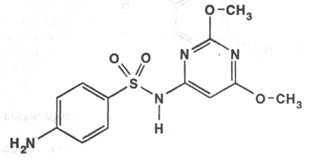
Получение: впервые получен в Австрии в 1953 году. Один из лучших препаратов пролонгированного действия – хорошо переносится больными, активен против большой группы микроорганизмов. Наиболее перспективен синтез, предложенный ВНИХФИ. Он основан на конденсации 6-амино-2,4-диметокси пиримидина с 4-ациламинобензолсульфохлоридом.
Описание: белый кристаллический порошок.
Растворимость: мало растворим в воде и спирте, растворим в разбавленных щелочах и кислотах.
Подлинность: препарат даёт все реакции, характерные для сульфаниламидов. Отличительной реакцией является взаимодействие с раствором сульфата меди. По ФС препарат спектрофотометрируют в 0,002 М растворе гидроксида натрия при длине волны 270 нм ( максимум поглощения ). Рекомендован способ измерения УФ-спектров поглощения щелочных растворов по сравнению с кислыми растворами равной концентрации. Такой дифференциальный УФ-спектр у сульфадиметоксина имеет минимум поглощения при 260 нм и два максимума: при 253 и 268 нм.
Чистота: по ФС методом ТСХ определяют примеси на пластинках “Силуфол УФ-254” в сравнении с веществом-свидетелем. Пятно должно быть одно. Устанавливается микробиологическая чистота препарата по ГФXI, в. 2, с. 193.
Количественное определение: по ФС – метод нитритометрии.
Хранение: список Б; в защищённом от света месте.
Применение: антибактериальное средство – пневмония, бронхит, ангина, гайморит, отит, менингит, дизентерия, воспалительные заболевания желчных и мочевых путей, раневые инфекции.
Форма выпуска: порошок, таблетки по 0,2 и 0,5 г; входит в состав мази “Левосин”.
Sulfalenum ( Sulfalene ). Сульфален нефармакопейный препарат
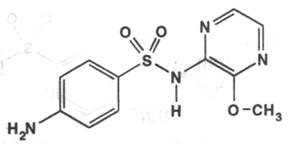 2-( п-Аминобензолсульфамидо )-3-метоксипиразин
2-( п-Аминобензолсульфамидо )-3-метоксипиразин
Описание: белый или белый с желтоватым оттенком кристаллический порошок без запаха.
Растворимость: практически нерастворим в воде, эфире, хлороформе и этаноле, легко растворим в растворах кислот и щелочей.
Подлинность: по ФС методом УФ-спектрофотометрии; в 0,1 М растворе гидроксида натрия имеет два максимума поглощения в диапазоне 210-360 нм при 250 и 318 нм. Рекомендован способ измерения УФ-спектров поглощения щелочных растворов по сравнению с поглощением кислыми растворами равной концентрации. Такой дифференциальный УФ-спектр у сульфалена имеет максимум поглощения при 325 нм. Препарат даёт все реакции, характерные для сульфаниламидов.
Чистота: по ФС методом ТСХ на пластинках “Силуфол УФ-254” в сравнении с веществом-свидетелем. Пятно должно быть одно. Устанавливается микробиологическая чистота препарата по ГФXI, в. 2, с. 193.
Количественное определение: по ФС – метод нитритометрии.
Хранение: список Б; в защищённом от света месте.
Применение: оказывает сверхдлительный эффект, используется при лечении бронхита, пневмонии, при холецистите, пиелите, цистите, уретрите и так далее.
Форма выпуска: таблетки по 0,2 г.
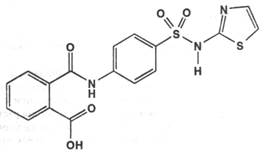
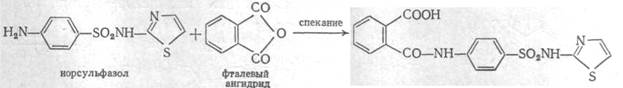
Phthalazolum ( Phthalylsulfathiazole ). Фталазол ( Фталилсульфатиазол ) фармакопейный препарат 2-( п-фталиламинобензолсульфамидо )-тиазол
Получение: спекание в электропечи фталевого ангидрида с норсульфазолом:
Описание: белый или с желтоватым оттенком порошок.
Растворимость: практически нерастворим в воде, эфире и хлороформе, очень мало растворим в спирте, растворим в водном растворе карбоната натрия, легко растворим в водном растворе гидроксида натрия.
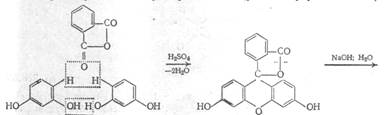
Подлинность: по ГФX – 1) 0,05 г препарата кипятят в 2 мл воды с 3 каплями разведённой хлороводородной кислоты 1-2 минуты. Полученный раствор даёт характерную реакцию на первичные ароматические амины; 2) к препарату прибавляют небольшое количество резорцина, 1-2 капли концентрированной серной кислоты и сплавляют на пламени горелки в течение 1-2 минут. После охлаждения полученную массу растворяют в 2-3 мл раствора гидроксида натрия и выливают в воду; наблюдается ярко-зелёная флуоресценция:
Дата добавления: 2016-02-04; просмотров: 9289;
