Молекулярно-генетический метод
Молекулярно-генетический метод – выявление изменений в определенных участках ДНК, гена или хромосомы. В его основе лежат современные методики работы с ДНК или РНК, В 70-80 гг. в связи с прогрессом в молекулярной генетике и успехами в изучении генома человека молекулярно- генетический подход нашел широкое применение,
Начальным этапом молекулярно-генетического анализа является получение образцов ДНК или РНК. Для этого используют геномную ДНК (вся ДНК клетки) или отдельные ее фрагменты. В последнем ее случае, чтобы получить достаточное количество таких фрагментов, необходимо, амплифицировать (размножить) их. Для этого пользуются полимеразной цепной реакцией – быстрым методом ферментативной репликации определенного фрагмента ДНК. С его помощью можно амплифицировать любой участок ДНК, расположенный между двумя известными последовательностями.
Анализировать огромные молекулы ДНК в том виде, в котором они существуют в клетке, невозможно. Поэтому прежде их необходимо разделить на части, обработать разнообразными рестриктазами – бактериальными эндонуклеазами. Эти ферменты способны разрезать двойную спираль ДНК, причем места разреза строго специфичны для данного образца. Расщепление ДНК рестриктазами дает характерный набор фрагментов (4-6 пар оснований), отличающихся по длинне.
Фракционирование фрагментов ДНК по размеру и длине проводится с помощью электрофореза на поверхности агарозного или акриламидного геля. Под действием электрического поля фрагменты ДНК начинают перемещаться вниз по гелю со скоростью, зависящей от их длины. В результате каждый фрагмент ДНК занимает определенное положение в виде дискретной полосы в конкретном месте геля. Длину каждого фрагмента можно определить путем сравнения расстояния, пройденного им и стандартным отрезком ДНК.
Молекулярно-генетическую диагностику наследственных болезней используют и для изучения генома человека. Чтобы выявить необходимые для этого специфические фрагменты ДНК, используют блот-гибридизацию по Саузерну. Сущность этой методики состоит в следующем: сначала осуществляют денатурацию ДНК с образованием одно-цепочечных фрагментов, которые переносят на нитроцеллюлозный или нейлоновый фильтр в буферном растворе.
Агарозный гель с фрагментами ДНК помещают на фильтровальную бумагу, смоченную концентрированным соленым раствором. На гель накладывают нитроцеллюлозный фильтр, а сверху помещают сухую фильтровальную бумагу, в которую впитывается соленый раствор. ДНК переносится вместе с раствором, но задерживается фильтром и практически полностью оказывается на его поверхности. Затем одно-цепочечные ДНК фиксируют на фильтре. Расположение фрагментов на фильтре точно соответствует их расположению в геле
Чтобы выявить нужные фрагменты проводят гибридизацию ДНК с реактивным ДНК-зондом или клонируемым фрагментом ДНК. Нуклеотидная последовательность зонда должна быть полностью или частично комплементарна изучаемому участку геномной ДНК.
Результат гибридизации комплиментарных цепей радиоактивного ДНК-зонда и фрагмента ДНК обнаруживают с помощью радиоавтографии: каждая комплиментарная зонду последовательность ДНК проявляется в виде радиоактивной полосы.
С помощью метода Саузерна можно составить рестрикционную карту генома в участке исследуемого генома и установить, несет ли данный ген какие-либо дефекты. Так, разработаны эффективные методы синтеза искусственных ДНК-зондов, которые используются в ренатальной диагностике наследственных заболеваний. Для этого из эмбриональных клеток, содержащихся в амниотической жидкости плода, выделяют ДНК и гибридизируют ее с помощью Саузерн-блотинга с радиоактивным ДНК-зондом. Аномальный эмбрион легко распознается, т.к. его ДНК будет гибридизоваться только с ДНК-зондом, комплементарным мутантной последовательности
В настоящее время имеются различные методы выявления мутаций. Их делят на прямые и косвенные. Прямая диагностика мутаций включает ряд методов:
1.Определение нуклеотидной последовательности, дающее возможность выявить замены оснований, делеции и вставки в изучаемом фрагменте.
2.выявление нарушения места рестрикции, с помощью блот - гибридизации по Саузерну. Около 50% нуклеотидных замен ведет к изменению места рестрикции. Это делает возможным выявить мутацию путем рестриктного анализа.
3.Проведение аллелоспецифической гибридизации с синтетическими зондами, что позволяет обнаружить мутации в геномной ДНК. Последовательность оснований в зонде может быть задача по дефектному или нормальному варианта гена. В обоих случаях зонд используется для гибридизации с фрагментами ДНК обследуемого индивида.
4.Химическое и ферментативное расщепление ДНК в местах неправильной сшивки оснований выявляет большую группу мутаций, ведущих к нестабильности ДНК. Метод заключается в электрофорезе двух цепочечной ДНК в нейтральном или равномерно денатурирующем гене.
5.Регистрация изменения электрофоретической молекулы ДНК.
6.Трансляция белкового продукта осуществляется в системе in vitro на основе получения специфической мРНК с добавлением лизата ретикулоцитов. Синтезируемый белок анализируют с помощью электрофореза. Изменение подвижности белка указывает на наличие мутации.
К косвенному выявлению мутаций прибегают в тех случаях, когда нуклеотидная последовательность гена еще не расшифрована, но известно ее положение на генетической карте. Технические приемы такие же, как и в прямой диагностике, но добавляется математический анализ.
9. Видимое строение хромосом человека и их морфология. Классификация и тонкая структура хромосомы
При анализе метафазных пластинок в световом микроскопе можно различить, что любая хромосома состоит из двух плеч и центромеры, или первичной перетяжки, выполняющей функцию механического центра хромосомы при делении (рисунок). Центромера является областью хромосомы, к которой при делении клетки прикрепляется нить веретена деления, разводящая хромосомы к полюсам клетки. Кроме первичной перетяжки некоторые хромосомы имеют вторичную перетяжку, не связанную с процессом прикрепления нитей веретена. Месторасположение вторичной перетяжки в хромосоме связано с образованием ядрышка, а этот участок хромосомы называют ядрышковым организатором. Длинное плечо хромосомы обозначается латинской буквой «q», короткое — «р».
Концевые участки хромосом имеют сегменты, препятствующие склеиванию хромосом своими концами, и тем самым способствуют сохранению их целостности. Эти сегменты были названы теломерами.
Некоторые акроцентрические хромосомы имеют так называемые спутники — участки, соединенные с остальной частью хромосомы тонкой нитью хроматина.
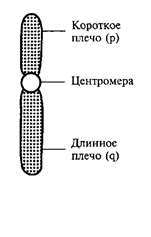
Рисунок - Схематическое изображение хромосомы
Такие хромосомы называют спутничковыми. Размер спутника относительно длины всей хромосомы постоянен для каждой конкретной хромосомы. В кариотипе человека спутники имеются у пяти пар хромосом: у 13, 14, 15, 21 и 22-й.
Классификация и номенклатура равномерно окрашенных хромосом человека впервые были приняты на международном совещании в 1960 году в г. Денвере, в дальнейшем несколько измененные и дополненные (1963 г., Лондон и 1966 г., Чикаго). Согласно классификации все хромосомы человека разделены на 7 групп, расположенных в порядке уменьшения их длины, и обозначаются буквами английского алфавита от А до G. Все пары хромосом стали нумеровать арабскими цифрами.
Группа А (1 —3-я) – самые большие хромосомы; 1 и 3-я -метацентрические, 2-я — субметацентрическая.
Группа В (4 и 5-я) — крупные субметацентрические хромосомы.
Группа С (6— 12-я и Х-хромосома) — субметацентрические хромосомы среднего размера.
Группа D (13— 15-я) — акроцентрические хромосомы средних размеров.
Группа Е (16—18-я) –– маленькие субметацентрические хромосомы.
Группа F (19 и 20-я) – самые маленькие метацентрические хромосомы.
Группа G (21, 22-я и У) – самые маленькие акроцентрические хромосомы.
Предложенная классификация позволяла четко различать хромосомы, принадлежащие к различным группам (рисунки).
С 1960 г. начинается бурное развитие клинической цитогенетики: в 1959 г. Дж.Лежен открыл хромосомную природу синдрома Дауна; К. Форд, П. Джекобе и Дж. Стронг описали особенности кариотипа при синдромах Клайнфельтера и Тернера; в начале 70-х гг. была открыта хромосомная природа синдромов Эдвардса, Патау, синдрома «кошачьего крика»; описана хромосомная нестабильность при ряде наследственных синдромов и злокачественных заболеваниях.

Рисунок - Хромосомный набор мужчины

Рисунок - Хромосомный набор женщины
Вместе с тем применение метода получения равномерно окрашенных хромосом оказалось недостаточно эффективным для идентификации хромосом.
В начале 70-х гг. были разработаны методы дифференциальной окраски хромосом, которые позволяли однозначно идентифицировать каждую хромосому. Методы были основаны на способности некоторых красителей специфически связываться с конкретными участками хромосом в зависимости от их структурно-функциональной организации. Предложенные методы выявляли линейную неоднородность (сегменты) хромосом. На практике наибольшее применение получили методы дифференциальной окраски красителем Гимза (G-окраска) и флюоресцирующим красителем акрихином или акрихинипритом (Q-окраска).
На рисунке представлены хромосомы человека при G-окраске. Хорошо видно, что каждая хромосома человека имеет только ей свойственную последовательность разношироких полос.
Это позволяет точно идентифицировать любую из хромосом и обнаруживать относительно крупные изменения в их структуре. При анализе метафазных хромосом средней конденсации можно четко различить около 350—400 относительно крупных сегментов на гаплоидный набор. На стадиях, предшествующих метафазе, хромосомы менее спирализованы и поэтому имеют большую поперечную подразделенность. Были разработаны методы анализа хромосом на делящихся клетках в стадии прометафазы. Использование этого методического подхода позволило получить хромосомы с разной степенью сегментации — от 800 до 2500 сегментов на гаплоидный набор.
Поперечная исчерченность, обнаруживаемая различными методами, в принципе выявляет одни и те же сегменты хромосомы и является результатом неравномерной конденсации хроматина по всей ее длине. В зависимости от степени спирализации ДНК в хромосоме выделяют гетерохроматиновые и эухроматиновые районы, для которых характерны различные функциональные и генетические свойства.
Гетерохроматиновый район представляет собой участок конденсированного хроматина (высокоспирализованная ДНК), который выявляется при дифференциальном окрашивании в виде темных полос. Присутствие гетерохроматина можно обнаружить и в интерфазном ядре, где он отчетливо выявляется в виде интенсивно окрашенных глыбок хроматина. Считывания генетической информации с данных участков не происходит. Различают структурный и факультативный гетерохроматин. Структурный гетерохроматин постоянно присутствует в определенных регионах хромосомы. Например, он всегда обнаруживается вокруг центромер всех хромосом. Факультативный гетерохроматин появляется в хромосоме при сверхспирализации эухроматиновых районов. Факультативной гетерохроматизацией может быть охвачена целая хромосома. Так, в клетках женского организма одна из Х-хромосом полностью инактивирована путем гетерохроматизации уже на ранних этапах эмбрионального развития. Ее можно обнаружить в виде глыбки гетерохроматина на периферии ядра. Такая инактивированная Х-хромосома называется половым хроматином, или тельцем Барра (рисунок). Благодаря гетерохроматизации Х-хромосомы в клетках женского организма происходит выравнивание количества генов, функционирующих в мужском и женском организмах, поскольку у мужчин имеется только одна Х-хромосома.
Эухроматиновые регионы хромосом в интерфазном ядре не видны, поскольку представлены хроматином в деконденсированном состоянии. Это указывает на их высокую метаболическую активность. Действительно, эухроматиновые районы содержат уникальные гены, контролирующие синтез различных белков. При дифференциальном окрашивании метафазных хромосом они определяются как светлые полосы.
Дата добавления: 2015-12-01; просмотров: 1255;
