ФАД‑зависимая оксидаза
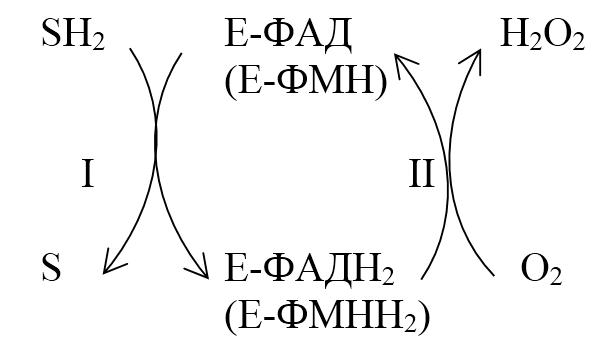
SН2 + О2 → S + Н2О2
В этой реакции энергия окисления выделяется в виде тепла. Реакции этого типа катализируют ФАД‑зависимые оксидазы (аэробные дегидрогеназы), содержащие в качестве простетической группы ФАД или ФМН. В клетке около 80 % этих ферментов сосредоточено в пероксисомах. Пероксидазный путь окисления активно протекает в лейкоцитах, макрофагах и других фагоцитирующих клетках. Образующийся пероксид водорода Н2О2 – сильный окислитель, обезвреживающий патогенные бактерии (защитная функция).
Реакция пероксидазного окисления протекает в 2 стадии:
1. Анаэробная ‑ происходит дегидрирование восстановленного субстрата SH2, при этом протоны и электроны переносятся на ФАД (ФАД + 2Н+ → ФАДН2).
2. Аэробная ‑ происходит окисление фермента (ФАДН2 → ФАД) кислородом (самопроизвольный процесс).
Биологическая роль оксидазного типа окисления:
1. защитная функция – в лейкоцитах и других фагоцитирующих клетках;
2. катаболизм биогенных аминов (фермент – моноаминооксидаза);
3. метаболизм аминокислот (ферменты – оксидазы D‑ и L‑аминокислот);
4. катаболизм пуринов (фермент – ксантиноксидаза);
5. катаболизм глюкозы в растительных клетках (фермент – глюкозооксидаза).
Диоксигеназный тип окисления
В процессе диоксигеназного окисления в молекулу субстрата включаются оба атома кислорода:
Диоксигеназа
S + O2 → SO2
Диоксигеназы катализируют разрыв двойной связи в ароматическом кольце. Например: гомогентизатоксидаза катализирует расщепление ароматического кольца гомогентизиновой кислоты с образованием малеилацетоацетата.
Монооксигеназный тип окисления
Монооксигеназы (гидроксилазы) катализируют включение в субстрат одного атома молекулы кислорода. Другой атом кислорода восстанавливается до воды. Для работы монооксигеназной системы необходим кроме неполярного субстрата (SH) донор атомов водорода – косубстрат (НАДФН+Н+, ФАДН2, аскорбиновая кислота):
Гидроксил
SH + НАДФН+Н++ О2 → SОН + НАДФ+ + Н2О
Монооксигеназные реакции необходимы для:
1. специфических превращений аминокислот, например, для синтеза тирозина из фенилаланина (фермент – фенилаланингидроксилаза);
2. синтеза холестерола, желчных кислот в печени; стероидных гормонов в коре надпочечников, яичниках, плаценте, семенниках; витамина D3 в почках;
3. обезвреживания чужеродных веществ (ксенобиотиков) в печени.
Ферменты монооксигеназного пути окисления локализованы в мембранах эндоплазматического ретикулума (при гомогенизации тканей эти мембраны превращаются в микросомы – мембранные пузырьки). Поэтому монооксигеназный путь окисления называют микросомальным окислением.
Микросомальное окисление представляет короткую электронтранспортную цепь, включающую НАДФ, ФАД, ФМН, цитохром Р450.
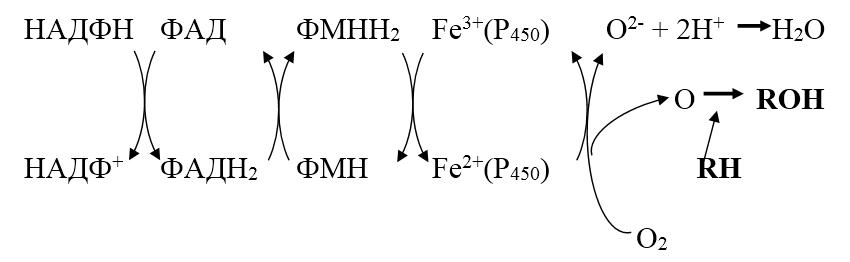
Микросомальная система включает два фермента: цитохром Р450 и НАДФН‑цитохром‑Р450‑редуктазу.
НАДФН‑цитохром Р450 – редуктаза – флавопротеин, в качестве простетической группы содержит два кофермента ФАД и ФМН.
Цитохром Р450 – гемопротеин, содержит простетическую группу гем и участки связывания для кислорода и субстрата. Восстановленный цитохром Р450 имеет максимум поглощения при 450 нм. Выполняет две функции: связывание окисляемого субстрата и активация молекулярного кислорода.
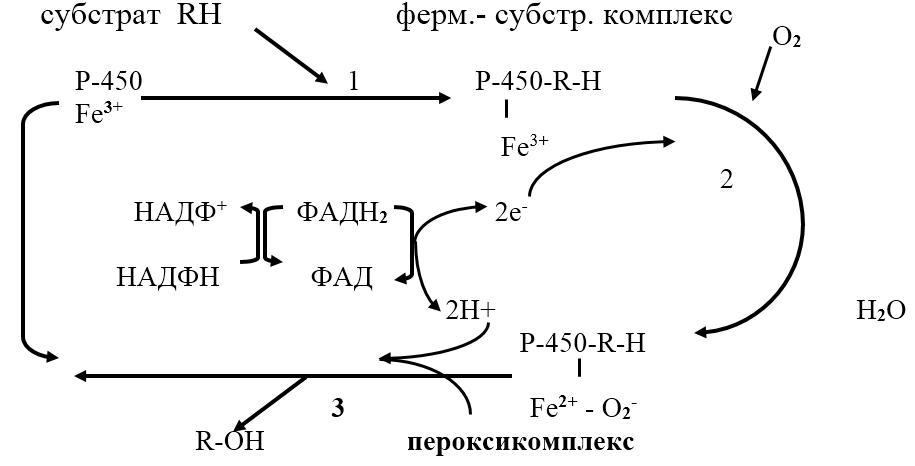
Рис. 11.1. Схема микросомального окисления
Микросомальное окисление протекает в несколько этапов:
1. связывание в активном центре цитохрома Р450 субстрата RН;
2. присоединение первого электрона и восстановление железа в геме до Fe2+; изменение валентности железа увеличивает сродство комплекса Р450 – Fe2+∙ RH к молекуле кислорода; присоединение второго электрона к молекуле кислорода и образование неустойчивого пероксикомплекса Р450–Fe2+∙ О2‑∙ RH;
3. Fe2+ окисляется, при этом электрон присоединяется к молекуле кислорода; восстановленный атом кислорода (О2‑) связывает два протона (донор протонов – НАДФН+Н+) и образуется 1 молекула воды; второй атом кислорода участвует в гидроксилировании субстрата RH; гидроксилированный субстрат ROH отделяется от фермента.
В результате гидроксилирования гидрофобный субстрат становится более полярным, повышается его растворимость и возможность выведения из организма с мочой. Так окисляются многие ксенобиотики, лекарственные вещества.
В редких случаях в результате гидроксилирования токсичность соединения увеличивается. Например, при окислении нетоксичного бензпирена (содержится в табачном дыму, копченостях) образуется токсичный оксибензпирен, который является сильным концерогеном, индуцирующим злокачественное перерождение клеток.
В митохондриях содержится монооксигеназная система, которая выполняет биосинтетическую функцию: синтез холестерола; стероидных гормонов (кора надпочечников, яичники, плацента, семенники); желчных кислот (печень); образование витамина D3 (почки).
Активные формы кислорода (свободные радикалы)
В организме в результате окислительно‑восстановительных реакций постоянно происходит генерация активных форм кислорода (АФК) при одноэлектронном восстановлении кислорода (молекула имеет неспаренный электрон на молекулярной или внешней атомной орбите).
Источники АФК:
1. цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород);
2. реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450;
3. реакции окисления в лейкоцитах, макрофагах и пероксисомах;
4. радиолиз воды;
5. под воздействием ксенобиотиков, пестицидов;
6. реакции самопроизвольного (неферментативного) окисления ряда веществ.
Супероксид‑анион – является одним из наиболее широко распространенных в организме свободных радикалов:
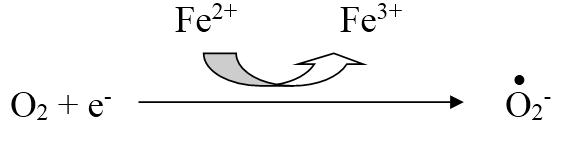
Он образуется в клетках болезнетворных бактерий и является повреждающим фактором для мембран клеток паренхиматозных органов человеческого организма. Для лейкоцитов и макрофагов супероксид‑анион является фактором бактерицидности, с помощью которого клетки инактивируют патогенные микроорганизмы.
Другой путь образования свободных радикалов – взаимодействие кислорода с металлами переменной валентности. При этом образуется пероксидный радикал:
Fe2+ + O2 + H+ → Fe3+ + •HO2
•O2‑ + Н+ → •HO2
Взаимодействие супероксиданиона с пероксидным радикалом (1) или одноэлектронное восстановление супероксид‑аниона (2) в водной среде приводят к образованию пероксида водорода
•O2‑ + •НО2 + Н+ → Н2О2 + О2 (1)
•О2‑ + е‑ + 2Н+ → Н2О2 (2)
Гидроксильный радикал ОН образуется при взаимодействии пероксида водорода с супероксид‑анионом (1) либо с металлами (2):
Н2О2 + •О2‑ → •ОН + ОН‑ + О2 (1)
Н2О2 + Fe2+ → •ОН + ОН‑ + Fe3+ (2)
Кислородные радикалы обладают высокой реакционной способностью и легко вступают в химические реакции с органическими молекулами для приобретения недостающего электрона. Кислородные радикалы оказывают воздействие на различные структурные компоненты клеток: ДНК (повреждение азотистых оснований); белки (окисление аминокислотных остатков, образование ковалентных «сшивок»); липиды; мембранные структуры.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, и инициируют тем самым цепные окислительные реакции. Если в реакцию с АФК вступают ненасыщенные жирные кислоты плазматических мембран, говорят о перекисном окислении липидов.
Перекисное окисление липидов (ПОЛ)
Реакции ПОЛ являются свободнорадикальными и постоянно протекают в организме, также как и реакции образования АФК.
В норме они поддерживаются на определенном уровне и выполняют ряд функций:
1. индуцируют апоптоз (запрограммированную гибель клеток);
2. регулируют структуру клеточных мембран и тем самым обеспечивают функционирование ионных каналов, рецепторов, ферментных систем;
3. обеспечивают освобождение из мембраны арахидоновой кислоты, из которой синтезируются биорегуляторы (простагландины, тромбоксаны, лейкотриены);
4. ПОЛ может выступать в качестве вторичного мессенджера, участвуя в трансформации сигналов из внешней и внутренней среды организма, обеспечивая их внутриклеточную передачу;
5. АФК участвуют в клеточном иммунитете и фагоцитозе.
Механизм ПОЛ:
1. Инициация . Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2‑ групп ненасыщенной жирной кислоты L, что приводит к образованию липидного радикала L•:
L + •OН → L•
2. Развитие цепи. Развитие цепи происходит при присоединении кислорода, в результате чего образуется пероксидный радикал LOO• или пероксид липида LOOH (гидроперекиси липидов)
L• + O2 → LOO•
LOО• + LH → LOOH + LR∙•
3. Обрыв цепи. Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами (витамином Е), которые являются донорами электронов:
LOO•∙ + L• → LOOH + LH
L∙•+ Витамин Е → LH + Витамин Е•∙
ВитаминТ Е• + L• → LH + Витамин Е окисл
В результате ПОЛ происходит преобразование обычных липидов в первичные продукты ПОЛ (гидроперекиси липидов). Это приводит к появлению в мембранах участков («дыр»), через которые наружу выходит содержимое как самих клеток, так и их органелл.
Первичные продукты ПОЛ разрушаются с образованием вторичных продуктов ПОЛ: альдегидов, кетонов, малонового диальдегида, диеновых коньюгатов. Накоплением в крови малонового диальдегида (МДА) объясняется синдром интоксикации, сопровождающий многие заболевания внутренних органов. Реагируя с SH‑ и СН3‑группами белков, МДА подавляет активность цитохром‑оксидаз (угнетая тем самым тканевое дыхание) и гидроксилаз. МДА обуславливает также ускоренное развитие атеросклероза.
При взаимодействии МДА с аминогруппами фосфолипидов образуются конечные продукты ПОЛ – Шиффовы основания. Примером этих соединений является пигмент липофусцин, появляющийся на оболочке глаза, на коже с возрастом. Липофусцин представляет собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, накапливается в клетках, нарушая их функцию.
Негативные последствия активации ПОЛ:
1. Повреждение липидного бислоя мембран, в результате чего в клетки проникает вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению.
2. Преждевременное старение клеток и организма в целом.
3. Взаимодействие высокореактивных продуктов ПОЛ с аминогруппами белков с образованием Шиффовых оснований.
4. Изменение текучести (вязкости) мембран, в результате чего нарушается транспортная функция мембран (функционирование ионных каналов).
5. Нарушение активности мембраносвязанных ферментов, рецепторов.
Активация ПОЛ характерна для многих заболеваний и патологических состояний:
1. атеросклероз и другие сердечнососудистого заболевания;
2. поражения ЦНС (болезнь Паркинсона, Альцгеймера);
3. воспалительные процессы любого генеза;
4. дистрофия мышц (болезнь Дюшенна);
5. онкологические заболевания;
6. радиационные поражения;
7. бронхолегочные патологии.
Дата добавления: 2016-01-30; просмотров: 2715;
