СТРОЕНИЕ И СОСТАВ ШЛАКА
После отбора пробы шлака и проведения соответствующего ее анализа мастер, ведущий плавку, получает данные о процентном содержании CaO, SiO2, FeO и т. д. При этом не следует забывать, что в лаборатории анализируют уже застывшую пробу шлака. Существуют различные представления о природе жидкого шлака и о взаимодействии его компонентов, согласно которым в жидких шлаках непосредственно в сталеплавильном агрегате между компонентами шлака возможны и ионная, и ковалентная связи. Преобладающей считается ионная связь. Схематически образование ионов при расплавлении компонентов шлака представляют обычно следующим образом:
FeO->Fe2+ +О2-. СаО->Са2++О2-;
МпО->Мп2++О2-. MgO->Mg2++O2-;
(FeO)2*Si02->2Fe2+ +SiO44-
(MnO)2 *SiO2-> 2Mn2+ +SiO44-;
FeS->F.e2+ +S2-; MnS->Mn2+ +S2-;
CaF2->Ca2++2F-;
(CaO)3*P2O5->3Ca2++3PO43- и т.п.
Какое-то количество этих элементарных структурных единиц (ионов) может входить в состав более или менее сложных комплексов или электронейтральных молекул оксидов. Примеры катионов: Fe2+, Мп2+, Са2+, Mg2+; примеры анионов: О2-, S2-, SiO44-.PO43-, Fe02-,Si2076-.
Состав ионов может изменяться в зависимости от состава шлаков; так, например, в кислом шлаке возможно присутствие следующих сложных ионов, включающих Si44+ и О2-: SiC44- ,Si2O76-,Si3O96-, Si4O128-,Si6O1812-. По мере усложнения размеры (радиусы) ионов увеличиваются (при этом соответственно возрастает вязкость шлаков). Силы взаимодействия ионов в шлаке зависят от отношения величины заряда иона к его радиусу (чем меньше радиус, тем сильнее данный ион при одинаковой величине заряда). Различие в силе ионов приводит к тому, что наиболее сильные катионы соседствуют с сильными анионами. Например, катион Fe2+ соседствует преимущественно с ионами О2-; таким образом, шлак приобретает определенную упорядоченность. Имея в виду ионный характер связей частиц в шлаке, основные реакции между компонентами шлака и металла можно выразить в следующем виде:
(Fе2+)+(02-)↔Fеж+[0];
(Fе2+) + (S2-)↔Fеж+[S]-
в случае железистого шлака;
[0]+(S2-)↔ [S]+(02-)-
в случае маложелезистого шлака;
(Мп2+)+(02) ↔ [Мп]+[0];
5(Fe2+)+2[P]+8(02-) <=> 2(РО43-)+5Fеж.
Для каждой реакции могут быть вычислены соответствующие константы равновесия. Для реальных шлаков, состоящих из многих компонентов, такие расчеты усложняются из-за отсутствия полных данных об активностях компонентов. Решение облегчается, если принять, что шлак представляет собой совершенный ионный раствор, т. е. если принять, что шлак состоит только из ионов, что силы взаимодействия всех анионов и всех катионов равноценны и что ближайшими соседями являются только разноименно заряженные ионы. Тогда активности компонентов шлака равны их ионным долям: aFe2+=xFe2+, aS2-=xS2-, +, aО2-=xО2-
Число молей тех или иных ионов рассчитывают при этом по данным химического состава шлака. Допускается, что nFe2+=n(FeO), nMn2+=n(MnO). nСа2+=n(СаО), nMg2+ = n(MgO), nSiO44- = n(SiO2). nS2- =n(S) и т. д. Присутствие в шлаках Fе2О3, Р2О5 и некоторых других оксидов не учитывается. Однако такой упрощенный подход дает положительные результаты только для ограниченного числа случаев. Предложенные методы расчета активностей компонентов шлака пока имеют частный характер и пригодны для расчетов шлаков лишь определенного состава. Надежные методы объективной оценки активностей компонентов шлака путем непосредственного измерения пока не разработаны (в настоящее время в ряде стран создают приборы для определения активности оксидов железа в шлаке). Для практических целей пользуются полуэмпирическими расчетными уравнениями. Комплекс представлений о характере ионной связи между составляющими жидких шлаков называют ионной теорией шлаков. Большой вклад в создание и развитие этой теории внесли ученые-металлурги О. А. Есин, В. А. Ванюков, П. А. Герасименко, В. А. Кожеуров, А. А. Шварцман, М. И. Темкин, В. И. Явойский и др. Упомянутая выше модель совершенных ионных растворов предложена М. И. Темкиным. В. А. Кожеуров разработал теоретические основы для вычисления коэффициентов активностей компонентов шлака. В. И. Явойский развил представления о механизме передачи газов(водорода, кислорода) из газовой фазы через шлак в металл. Работы в этом направлении продолжаются, так как общая теория строения шлаков еще далека от совершенства. Для отдельных случаев практики разработаны частные решения. Помимо полуэмпирических уравнений можно использовать разработанные специальные диаграммы. Так, для шлаков, состоящих из CaO, SiO2 и FeO (или шлаков близкого состава), активность FeO часто вычисляют по диаграммам Тейлора и Чипмена, Туркдогана и Пирсона, Эллиота и Бодеуорта. Эти диаграммы обычно имеются в справочниках и учебниках (рис. 9.2).
' 1Такое название отличает эту теорию от молекулярной теории шлаков, в соответствии с которой шлаки состоят из молекул, причем одна часть компонентов шлака связана в соединения (силикаты, ферриты и т. п.), а другая часть находится в свободном состоянии. Концентрации свободных компонентов (CaO, MgO, FeO — в основных, SiCb — в кислых шлаках) определяются их избытком по сравнению с количеством, необходимым для образования тех или иных соединений в соответствии со стехиометрическим составом последних. Молекулярную теорию шлаков часто связывают с именем немецкого металлурга Г. Шенка, разработавшего метод расчета концентраций свободных оксидов.
Данные анализа проб шлака металлурги получают с соответствующим пересчетом на массовый состав; при этом приводится содержание компонентов шлака в виде обычных оксидов (FeO, CaO, MnO, SiO2 и т.д.) или в чистом виде [(Fe), (S), (Р) и т.д.]. Составляющие шлак оксиды в соответствии с их химическими свойствами можно разделить на три группы:
1) кислотные (SiO2, P2O5, TiO2, V2O5);
2) основные (CaO, MgO, FeO, MnO);
3) амфотерные (А12О3, Fe2O3, Cr2O3).
Из минералогического анализа шлаков различных вариантов сталеплавильных процессов следует, что наиболее часто встречающимися соединениями в шлаковых пробах являются:
силикаты — FeO-SiO2, (FeO)2-SiO2, MnO-SiO2, (MnO)2-SiO2, (CaO)2-SiO2, (CaO)3-Si02, MgO-Si02, (MgO)2-Si02, Al2O3-SiO2;
фосфаты — (FeO)3-P2O5, (MnO)3-P2O5, (CaO)3-P205, (CaO)4-P205, (MgO)3-P2O5;
алюминаты — FeOA12O3, CaOAl2O3, MgO-Al203;
ферриты — FeO-Fe2O3, CaO-Fe2O3, (CaO)3-Fe203, (CaO)m-(Fe2O3)n.
Из соединений более сложного состава чаще встречаются такие, как монтичеллит СаО-Ж>8Ю2 (где R= Fe, Mn, Mg), мервинит 3 СаО*RO*2 SiO2, силикокарнотит 5 CaOP2O5*SiO2, a также различные шпинели смешанного состава типа алюмоферрита кальция 4CaO*Al2O3*Fe2O3. В хромистых шлаках образуется хромовая шпинель (РеО)n*(Сг2О3)m переменного состава. В высокомагнезиальных шлаках могут присутствовать твердые включения кристаллов периклаза MgO. В высокоосновных шлаках в виде твердых включений может также присутствовать СаО. Все эти соединения обнаружены при минералогическом анализе проб затвердевшего шлака
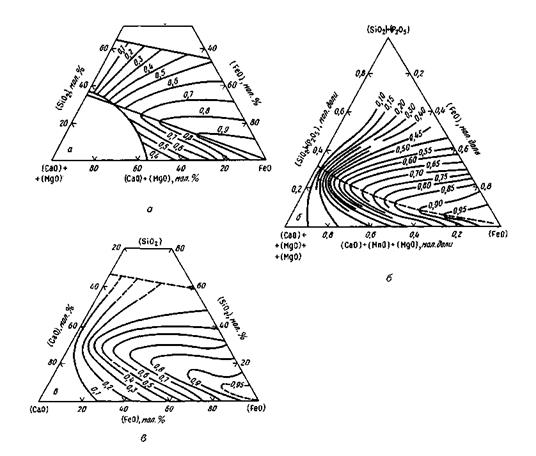
Рис. 9.2.Диаграммы для определения активности монооксида железа FeO в шлаковых расплавах, а<PеО):
а —по Тейлору и Чипмену; 6— по Туркдогану и Пирсону; в — по Эллиоту и Бодеуорту
Часто формулы сложных соединений используют при описании процессов, протекающих в сталеплавильных агрегатах, в которых шлак находится в расплавленном состоянии. Необходимо помнить, что по химическим формулам, например FeO или (CaO)2*SiO2 , нельзя установить, находятся ли данные вещества в расплавленном шлаке в виде молекул или ионов. В подобных формулах отражено только соотношение элементов в рассматриваемых шлаках.
Шлак, в котором преобладают основные оксиды (СаО, MgO, MnO, FeO), называют основным', если в составе преобладают кислотные оксиды, шлак называют кислым. В сталеплавильном производстве работают со шлаками обеих групп: кислыми (45— 60% SiO2, 35-45% (FeO + MnO)) и основными (35-60 % (СаО + MgO), 10-25% FeO, 15-30% SiO2, 5-20% MnO). Диаграммы состояния шлаковых систем показаны на рис. 9.3 и 9.4.
Под основностью шлака понимают отношение массовых концентраций (CaO)/(SiO2) или в случае высоких концентраций фосфора (CaO)/((SiO2) + (Р2О5)). Какой-либо общепринятой градации шлаков в зависимости от их основности нет, однако часто шлаки по признаку основности делят на три группы: низкоосновные — если (CaO)/(SiO2) < 1,5; средней основности - если (CaO)/(SiO2) = 1,6+2,5 и высокоосновные —если (CaO)/(SiO2) > 2,5. Знание основности шлака (для основных процессов) и постоянный контроль за этим параметром очень важны, так как с помощью этой характеристики шлака обычно определяют важнейшее его свойство — способность извлекать из металла вредные примеси (серу, фосфор) и удерживать их в шлаке.
Характеристикой кислых шлаков может служить отношение (SiO2)/(FeO + MnO) или (SiO2)/(FeO + MnO + СаО), которое называют кислотностью шлака.
Важнейшей характеристикой шлака является также величина, называемая окисленностью шлака. Под окисленностью шлака обычно понимают способность шлака передавать металлу кислород. Роль основного окислителя при взаимодействии металла со шлаком принадлежит оксиду железа (FeO). Определенную роль играет также и трехвалентное железо (Fe2O3).
Соотношение двух- и трехвалентного железа в шлаке регулируется по-разному, в том числе составом шлака и окисленностью газовой фазы. Характер влияния этого соотношения на протекание процесса передачи кислорода из шлака в металл достаточно сложен и до конца не изучен. Сложившаяся практика определения окислительной способности шлака свидетельствует об отсутствии полной ясности и единства мнений в этом важном вопросе. Встречаются следующие варианты расчетов окислительной способности основных шлаков на разных заводах (и по данным разных литературных источников).
1. Определение суммарной массовой концентрации FeO в шлаке, рассчитанной по кислороду (%):
∑(FeO) = (FeO) + l,35(Fe2O3).
2. Определение суммарной массовой концентрации кислорода (%), содержащегося в оксидах железа в шлаке:
∑ (0) = 0,222(FeO) + 0,300(Fe2O3).
3. Определение суммарной массовой концентрации оксидов железа в шлаке (%):
∑ (FeO) = (FeO) + (Fe2O3).
4. Определение суммарной массовой концентрации FeO в шлаке (%), рассчитанной по железу:
∑ (FeO) = (FeO) + 0,9(F2O3).
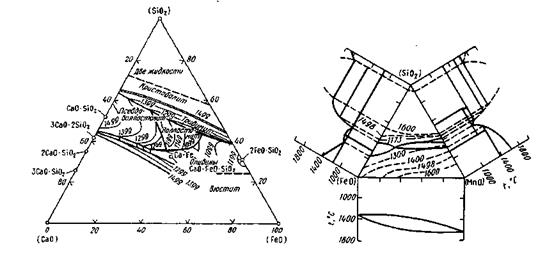
Рис. 9.3.Диаграмма состояния CaO-SiO2-FeO Рис. 9.4. Диаграмма состояния FeO-SiO2-MnO
5. Определение суммарной массовой концентрации железа (%), содержащегося в оксидах железа в шлаке:
Fеобщ или  (Fe) = 0,778(FeO) + + 0,700(Fe2O3).
(Fe) = 0,778(FeO) + + 0,700(Fe2O3).
6. Определение массовой концентрации (FeO) в шлаке (%) (содержание Fe2O3 не учитывается).
7. Определение активности FeO в шлаке — a(FeO). Активность определяется экспериментально или рассчитывается.
8. По формуле R(FeO) = (FeO) -— k(Fe2O3) учитывается, что Fe2O3 как амфотерный оксид участвует в основном шлаке в образовании сложных комплексов типа (CaO)*(MgO)x*(FeO)y *(Fe2O3)z или анионов типа Fex Oyz-, снижая содержание свободных ионов Fe2+ и O2-, т. е. уменьшая a(FeO). Величина k для условий обычной плавки в основной мартеновской печи близка к 0,7.
Наиболее достоверные результаты получаются при оценке окислительной способности шлака двумя последними методами (пп. 7 и 8). Исследованиями сотрудников Института черной металлургии Украины с использованием различных методик на большом массиве данных о составе металла и шлака по ходу продувки в кислородном конвертере установлено, что увеличение содержания FeO в шлаке приводит к увеличению окислительной способности шлака, а увеличение содержания Fe2O3 свидетельствует о снижении этой способности и об увеличении основности шлака. Исходя из этого, в частности, не рекомендуется использовать при описании и исследовании процесса такой критерий, какFeОбЩ'
Дата добавления: 2016-01-29; просмотров: 1085;
