Нет, не бедный родственник!
Алюминий занимает по распространенности в земной коре первое место среди металлов. После кислорода и кремния он является самым распространенным элементом. Земная кора содержит 7,45 процента алюминия. Академик А. Е. Ферсман насчитал около 250 минералов, содержащих алюминий.
Однако никто никогда не нашел на Земле ни одного даже самого крохотного слитка самородного алюминия. Из‑за своей большой химической активности он встречается в природе только в виде соединений.
Почему же не окисляется, не сгорает мгновенно, как это происходит, например, с калием, кусочек чистого алюминия, попав на воздух?
Да, он сразу же начинает сгорать, окисляться. Его сверкающая поверхность тускнеет, покрывается матовым налетом. Но на этом и кончается процесс окисления. Образующаяся пленка окиси алюминия обладает большой прочностью. Как броней покрывает она нестойкий металл.
Стойкостью этой пленки и объясняется способность алюминия сопротивляться действию тех или иных агрессивных жидкостей. Концентрированная азотная кислота и органические кислоты бессильны разрушить ее, и поэтому на алюминий они не действуют. Едкие щелочи растворяют защитную пленку, и горе той домашней хозяйке, которая вздумает вскипятить в алюминиевом чайнике щелочь, – чайник придется сдать в утиль.
Технический алюминий, содержащий не более половины процента примесей, плавится при 658 градусах, кипит при 2500 градусах. Почти в двухтысячеградусном диапазоне температур алюминий продолжает оставаться жидким.
Алюминий – легкий металл. Он почти в три раза легче железа. Его удельный вес – 2,7 (удельный вес стали – 7,8).
Алюминий – мягкий металл. Он легко поддается всем видам механической обработки: прокатке, резанию, волочению, ковке и т. д. Он непрочен – предел прочности литого технического алюминия равен 3–12 кг на кв. мм. Уже простая прокатка повышает прочность этого металла. Прокатанный алюминий выдерживает до 18–28 кг на кв. мм. Однако при этом резко снижается пластичность: у литого она равна 18–25, у прокатанного –3–5 процентам.
Вспомним, что предел прочности широко распространенной качественной углеродистой стали, содержащей около 0,3 процента углерода, равен примерно 45–50 кг на кв. мм, а удлинение– 20 процентам.

Даже ливень из кислот не страшен ему!
Алюминий обладает высокой электро‑ и теплопроводностью. В ряду металлов по этим свойствам он занимает третье место, сразу за медью. У технического алюминия электропроводность, в зависимости от чистоты, составляет примерно 65 процентов от электропроводности меди.
Нет, алюминий не бедный родственник, уступающий своим более счастливым соперникам – железу по прочности, меди по электропроводности. Надо поглубже разобраться в его свойствах.
Не будем говорить о сплавах алюминия, механические свойства которых приближаются к некоторым сортам мягкой стали. Посмотрим свойства простого прокатанного алюминия.
Изготовим из него круглый стержень, равный по длине и весу другому стержню, изготовленному из стали и имеющему в сечении 1 кв. мм. Очевидно, что алюминиевый стержень будет несколько толще стального, но на них пошли одинаковые по весу количества металла. Попробуем их прочность.
Стальной стержень‑проволочка разорвется как только усилие превысит 40 кг. Это – прочность хорошей конструкционной углеродистой стали, из которой изготовляют болты, винты, фермы и т. д.
Начинаем разрывать алюминиевый стержень. Подвешиваем к нему 20‑килограммовую гирьку – выдерживает. Добавляем еще 20 килограммов. Ого! Этого не выдерживала уже и наша сталь! И только когда вес груза перевалил за 60 кг, лопнул алюминиевый стерженек. Он оказался почти в полтора раза прочнее стального.
Значит, фермы из прокатанного алюминия, равные по прочностям стальным, будут в полтора раза легче. Значит, можно будет реже поставить быки‑опоры, длиннее сделать пролеты, если из алюминия построить мост через реку. Значит, можно выше поднять шпиль телевизионной башни, если изготовить ее из алюминия. Значит, большим будет полезный вес состава из одинаковых по прочности со стальными алюминиевых вагонов.
Совсем не бедным родственником, а имеющим важное преимущество соперником оказывается алюминий при таком сравнении со сталью!
Если мы приведем такое же сравнение алюминиевых и медных проводов, мы убедимся, что и здесь алюминиевый провод равного сопротивления току с медным окажется более легким. Реже встанут опоры высоковольтной линии с алюминиевыми проводами, более легким окажется ротор мотора и генератора с алюминиевой обмоткой. И здесь – преимущество алюминия.
Эти преимущества и предопределили широчайшее применение алюминия. Важным его потребителем является электротехника. Кабели и шинопроводы, конденсаторы и выпрямители переменного тока, провода и приборы делаются из алюминия.
Из рафинированного алюминия можно прокатать фольгу тоньше папиросной бумаги, вытянуть проволоку тоньше паутинки. Кстати, и такая проволока и такая фольга находят важнейшее применение в радиотехнике.
Высокая коррозионная стойкость алюминия позволяет широко использовать его в химической промышленности. Аппаратура для производства азотной кислоты, многих органических веществ, пищевых продуктов (включая и домашнюю посуду) – все это область алюминия.
Но главный потребитель алюминия – авиация. Подавляющее большинство современных самолетов во всех странах мира делается из алюминия.
Немало алюминиевых деталей и в современном автомобиле. Делают из алюминия автобусы, железнодорожные вагоны. Наверное, все видели алюминиевую мебель – легкую, прочную, изящную.
И чем дальше, тем большее применение будет находить чудесный металл. Единственное, что мешает ему вытеснить железо буквально изо всех областей применения, – его еще высокая стоимость.
Рождение в молнии
Металлургический завод, на котором получают чистый алюминий, очень непохож на своего собрата, производящего чугун и сталь. Здесь нет гигантских башен доменных печей, тяжелых мартенов, громоздкого блюминга. Не в пламени сгорающего кокса, а в горячей электролитной ванне, пронизанной потоками электрического тока, достаточными, чтобы породить молнию, рождается чистый металл. Но здесь, в этой электролитической ванне, сходятся, как и в домне, многие технологические линии.
Одна из этих линий – производство чистого глинозема, чистой окиси алюминия.
Не многие из двухсот пятидесяти содержащих алюминий горных пород могут служить рудой для получения глинозема. Одни из них содержат глинозем в такой форме, что извлечь его слишком трудно, в других глинозема просто мало, третьи сами встречаются слишком редко или в небольших количествах. Поэтому наиболее часто используются бокситы.
В состав бокситов входят, кроме соединений алюминия, также соединения железа, титана, кремния и т. д. Внешне эта руда алюминия представляет глиноподобную или каменистую породу. Общие разведанные запасы ее определяются более чем миллиардом тонн. Больше всего бокситов найдено в Европе, меньше – в Африке, еще меньше – в Америке и Азии.
Богата залежами бокситов и наша страна. Они имеются в Ленинградской области (близ города Тихвина), на Северном Урале, на Южном Урале, в Красноярском крае и т. д.
Неспециалист не скажет, если перед ним положить на стол два куска бокситов, но один из‑под Тихвина, а другой из южноуральского месторождения, что это одна и та же горная порода. Да и в пределах одного месторождения бокситы внешне могут очень отличаться друг от друга. Так, тихвинские бокситы встречаются всех цветов – от белого до красного и фиолетового. Непостоянен и их удельный вес. И, конечно, непостоянен химический состав.
Обычно в бокситах содержится от 50 до 60 процентов глинозема. Впрочем, в лучшем случае эта цифра может быть и значительно выше.
Глинозем… Когда мы произносим это слово возникает представление о чем‑то грязно‑землистом, сером, аморфном. Но это неверно. Ведь одной из разновидностей бокситов является корунд. Это очень твердый кристаллический минерал. Только алмаз тверже корунда, поэтому корундовые круги применяются для заточки инструмента, а мелкий корундовый порошок – для шлифовки. Это далеко не аморфная глина!
Корунд не всегда имеет и грязно‑серый цвет. Драгоценнейшие камни – красный, как пламя, рубин, синий, как морская вода, сапфир, желтый, как кошачий глаз, топаз, фиолетовый «восточный» аметист, зеленый «восточный» изумруд – все это окись алюминия, глинозем, корунд, содержащие в себе неуловимо малые примеси других металлов, создающих их волшебную окраску. Но каждый из этих дивных самоцветов может служить рудой в производстве алюминия.
Вот, оказывается, каких родственников имеет обычный глинозем – безводная окись алюминия, которую надо получить из бокситов!
Есть много способов получения глинозема. Наиболее часто применяется так называемый щелочный метод. Вот он.
Тяжелые самосвалы выгрузили каменистые глыбы боксита в приемный бункер щековой дробилки. Куски величиной до 40–60 см в поперечнике она разгрызает до размера обычного булыжника. Но и этого еще недостаточно. Эти куски руды поступают в конусные дробилки, из которых руда попадает в шаровые мельницы. И только теперь частицы руды поступают в автоклавы для выщелачивания.
Автоклавы – это высотой с трехэтажный дом стальные цилиндры, способные выдержать большое внутреннее давление. Ведь порошок боксита, который загружают в автоклав и заливают щелочью, лучше всего отдает в раствор соединение алюминия при температуре в добрых пару сотен градусов и давлении не менее десятка атмосфер. И несколько часов бурлит автоклав (пульпу в нем непрерывно перемешивают струей пара, проходящего сквозь всю ее толщу), пока длится процесс «варки» боксита.
Химическая суть этого процесса довольно сложна. Со щелочью вступает в реакцию не только окись алюминия, но и другие вещества, входящие в состав боксита, – кремнезем, окислы титана, ванадия и т. д. Некоторые из образовавшихся веществ вступают в реакции между собой. Однако большая часть получающихся в конечном результате веществ остается в твердом осадке. В растворе же концентрируется соединение алюминия, загрязненное некоторым количеством соединений кремния, фосфора, хрома и т. д.
Скажем сразу: процесс выщелачивания – сложный, тонко регулируемый процесс. На его ход оказывают влияние и состав боксита, и концентрация щелочного раствора, и продолжительность его, и температура, и давление в автоклаве. Кроме того, далеко не всегда весь процесс выщелачивания идет в одном автоклаве. Чаще этот процесс делают непрерывным, соединяя ряд автоклавов друг с другом. Это повышает производительность процесса. Но во всех случаях, чтобы добиться извлечения не менее 85 процентов глинозема из бокситов, нужно высочайшее умение инженеров.
Из варочного автоклава пульпа давлением пара выгружается в самоиспаритель. Давление резко падает, и начинается бурное кипение жидкости. Когда оно прекращается, пульпа направляется на разбавление. Разбавляют пульпу водой, которой перед этим промывали твердый остаток – так называемый красный шлам.
После разбавления алюминатный раствор отделяется от твердого шлама. Для того чтобы мелкие твердые частицы быстрее отделялись от жидкости, в пульпу добавляют так называемые коагулянты – вещества, способствующие слипанию отдельных твердых частиц в крупные хлопья. В качестве такого коагулянта нередко используют обыкновенную ржаную муку. Затем алюминатный раствор фильтруют и направляют на разложение. Твердый остаток после промывки водой для извлечения последних капель раствора вывозят на свалку.
Разложение алюминатных растворов – также очень сложная и тонкая операция. Осуществляется она в гигантских цилиндрических резервуарах, снабженных мешалками, – так называемых декомпозерах. Раствор, имеющий вначале температуру около 60 градусов, постепенно перетекает по системе сифонов из одного резервуара в другой. В ходе процесса в раствор всыпают кристаллы гидроокиси алюминия. Они становятся центрами кристаллизации. Длится этот процесс, называемый технологами выкручиванием, трое‑четверо суток.
Конечно, далеко не весь алюминий уходит из раствора. Почти половина его остается в жидкости. Но он не пропадает. Ведь эта жидкость после отделения от нее выделившейся гидроокиси алюминия возвращается в автоклавы для выщелачивания. Так она и циркулирует непрерывно, растворяя в автоклавах глинозем и выделяя его в твердом виде в декомпозере.
Последней операцией получения чистого глинозема является кальцинация – обезвоживание полученного вещества. Осуществляется она в гигантских – метров в 50–75 длиной и метра 1,5–2 диаметром – барабанных вращающихся печах. В поднятый конец этой печи‑трубы вводится гидроокись алюминия. Она медленно передвигается по наклону печи вниз, навстречу жаркому пламени мазутных или газовых горелок. В процессе нагревания и прокаливания до температуры в 1250 градусов большая часть гидроокиси превращается в безводную окись алюминия, тот самый корунд, из которого состоят рубины и топазы.
Безводный глинозем – термически стойкий окисел. Температура его плавления равна 2050 градусам. Не просто получить такую температуру в электролизной ванне. И, вероятно, если бы не нашли обходного способа получения алюминия, кроме прямого электролиза расплавленного глинозема, этот металл и сегодня оставался бы драгоценным.
Но способ был найден. Нашли вещество, в котором глинозем хорошо растворяется, и этот‑то раствор и подвергают электролизу.
Это вещество называется криолит.
Криолит также является соединением, содержащим в своем составе алюминий. Кроме этого металла, в нем содержатся еще натрий и фтор. Единственное крупное месторождение этого минерала находится в холодной Гренландии. Его внешний вид символичен: он напоминает лед. Кусок криолита, положенный в стакан с водой, почти невидим. Аборигены Гренландии считали долгое время криолит льдом, спрессованным до такой степени, что его уже нельзя растопить. Впрочем, отдельные куски криолита могут иметь снежно‑белый, розоватый или даже черный – в зависимости от примесей – цвет.
Криолит встречается в нашей стране на Урале, но его очень мало. Поэтому и криолит приходится приготовлять искусственно.
Сырьем для производства криолита служит плавиковый шпат. Эта горная порода встречается значительно чаще. В Советском Союзе, в частности, большие запасы плавикового шпата имеются в Забайкалье и Средней Азии. Скажем сразу: получение криолита – не менее сложный и тонкий процесс, чем получение глинозема. Как и тот, он начинается с обогащения и последующего измельчения плавикового шпата, в состав которого входят кальций и фтор.
Размельченный в тонкий порошок плавиковый шпат смешивают в специальных дозаторах с концентрированной серной кислотой, и эту смесь направляют в реакционную печь. Это клепанный из котельного железа, герметически закрытый вращающийся барабан. Смесь шпата и кислоты реагирует в нем при температуре около 130 градусов. В результате реакции получается чрезвычайно ядовитый газ – фтористый водород и гипс. Газ выводится через специальный патрубок и по свинцовым трубам идет на очистку, а гипс шнеки выбрасывают из печи.
После очистки фтористый водород растворяют в воде. Производится это в свинцовых башнях. Фтористая кислота разъедает даже стекло– именно с помощью этого вещества вытравляют на нем надписи и рисунки. Свинец – один из немногих материалов, против которых она бессильна, поэтому из него и делают башни. Растворение фтористого водорода в воде сопровождается выделением тепла, а в результате образуется плавиковая кислота.
Полученную плавиковую кислоту очищают от примесей и производят «варку» криолита. Для этого в нее добавляют ту самую гидроокись алюминия, что была получена при «выкручивании» алюминатных растворов, и соду, В результате ряда последовательных реакций и образуется выпадающий в виде осадка криолит.
Это осуществляется в железных чанах, футерованных угольными плитками и снабженных мешалками. В них непрерывно подают пульпу, содержащую гидроокись алюминия и раствор соды. Тщательно соблюдается необходимая дозировка.
Затем криолитовую пульпу сгущают, отделяют в фильтрах от жидкости твердые частицы криолита, и высушивают их в сушильных барабанах при температуре в 130–140 градусов.
Вот каким сложным путем получается похожий на гренландский нетающий лед искусственный криолит. Это с ним встречается глинозем в электролитической ванне.
Третий участник этой встречи – угольный электрод.
Нехитрая, кажется, вещь эти цилиндрические и прямоугольные угольные плиты, спускающиеся в ванну с криолито‑глиноземным расплавом. А и их производство – сложный и деликатный процесс, которым занимаются специальные заводы. Ведь все, что входит в состав электрода, при его сгорании рано или поздно попадает в ванну и загрязняет получаемый металл. Поэтому должны быть очень чистыми исходные материалы. Они должны быть достаточно электропроводными, плотными, иметь значительную механическую прочность.
Не будем детально проходить всю цепочку технологических процессов, ведущих от исходных материалов – антрацита, нефтяного кокса, пекового кокса, каменноугольной смолы и т. д. к готовому электроду. Скажем лишь, что она включает в себя дробление исходных материалов, их прокаливание, размол, классификацию, строгую дозировку и смешивание, прессование и обжиг. И только пройдя все эти операции, приходит электрод в электролизный цех алюминиевого завода.
В настоящее время применяют аноды, самообжигающиеся в процессе работы. Но приготовление углеродистого материала для них – не проще.
В электролизном цехе стоят в ряд, одна рядом с другой огромные ванны. В них под коркой застывшего криолита в криолито‑глиноземном расплаве электрический ток буквально по атому отбирает алюминий. Он выделяется на дне ванны. Это дно (оно выложено угольными плитами, в которые вделаны залитые чугуном провода) служит катодом. Спускающиеся сверху угольные электроды являются анодами. На них непрерывно выделяется кислород, и они медленно сгорают.
Невелико напряжение тока, работающего в ванне, не более 5 вольт, но зато колоссальна его сила, достигающая у крупных ванн 15 000 тысяч ампер и даже больше. Гигантская электрическая река протекает сквозь расплав, вымывая из него атомы драгоценного металла и складывая их в одно место. Этой реки хватило бы на непрерывный плеск молний. И действительно, иногда электрическая река становится зримой: вокруг анода возникают искры, крохотные молнии. Это свидетельствует о нарушении правильного режима работы ванны.
Мы помним, что чистый глинозем плавится при температуре выше 2 тысяч градусов. Расплав в ванне имеет температуру всего около 950 градусов. Вот он, тот обходный путь, который делает алюминий общедоступным.
Конечно, общедоступность эта еще очень условна. Мы проследили уже, каким сложным путем пришли в электролизный цех основные материалы, без которых невозможно получение алюминия. Эта сложность удорожает металл, да к тому же и сам процесс электролиза не дешев: ведь для выработки 1 тонны алюминия надо затратить 17 500 киловатт‑часов электроэнергии!
Очень много? Да, очень много. Но в первых конструкциях ванн, на заре советской алюминиевой промышленности, на тонну алюминия приходилось затрачивать целых 40 тысяч киловатт‑часов. Увеличением размера ванн, уменьшением теплопотерь, улучшением самой конструкции ванны снизили расход энергии более чем вдвое. И, конечно, он будет еще снижен.
Такое снижение вполне возможно. Теоретические расчеты показывают, что едва трети потребляемой энергии достаточно для выделения из расплава чистого алюминия. Остальные две трети – потери. Это потери и очевидные – с теплом, излучаемым ванной в окружающее пространство. Это потери и за счет скрытого от непосредственного наблюдения процесса растворения уже полученного чистого алюминия со дна ванны в плавающем над ним криолите. И, конечно, все эти потери еще можно уменьшить. Но главную статью в себестоимости алюминия составляет стоимость глинозема. Удешевление его производства тоже возможно как за счет частных усовершенствований, так и принципиальным изменением технологии.
Сегодня тонна «серебра из глины» стоит столько же, сколько сто лет назад стоил килограмм этого металла. Когда его стоимость снизится еще в десять раз, он повсюду вытеснит железо и его сплавы.
Но мы отвлеклись. Полученный в ванне алюминий еще надо извлечь, очистить от примесей.
Расплавленный металл из ванн извлекают или с помощью вакуум‑ковшей, в которые по железной трубке засасывается металл, или с помощью специальных сифонов. За сутки ванна на 50 тысяч ампер вырабатывает примерно 360 кг алюминия. Металл извлекают из нее через каждые двое‑трое суток.
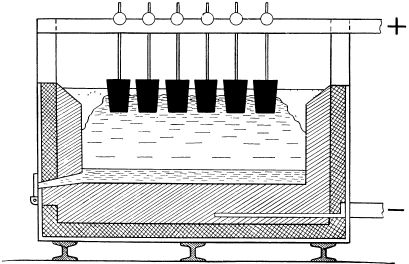
Вот она, простейшая схема электролитической ванны.
Ковш с алюминием сразу же ставят в специальную камеру, опускают в него трубку и прокачивают сквозь расплавленный металл хлор. Он уносит с собой большую часть механических примесей, собирающихся в виде рыхлого порошка на поверхности металла. Его снимают дырчатой ложкой, напоминающей шумовку, которой домашние хозяйки снимают пену с мясного супа. Затем металл направляют в рафинировочную печь. В ней смешивается алюминий из разных ванн, происходит усреднение состава, некоторая очистка. Затем металл разливают в изложницы разливочной машины.
Слитки, предназначенные для механической обработки, отливают методом полунепрерывного литья. При этом получается лучшая кристаллическая структура слитков.
Таков процесс рождения технического алюминия. Он еще содержит в среднем около 0,5 процента посторонних примесей – главным образом железа и кремния. Дальнейшая очистка алюминия (а мы знаем, что сверхчистые металлы обладают совершенно особыми свойствами) осуществляется также электролитическим методом. Удается получить металл, содержащий не больше 0,002 процента примесей. Такой алюминий обладает повышенной электропроводностью, пластичностью и, что особенно важно, сверхвысокой антикоррозионной стойкостью. Из него изготавливают высокосортную фольгу, химическую и электрическую аппаратуру, им покрывают поверхности других металлов для защиты от коррозии.
Однако в подавляющем большинстве случаев алюминий применяется не в чистом виде, а в сплаве с другими металлами.
Алюминий в сплавах
Алюминий не сразу стал металлом авиации. Было время, тяжелая сталь спорила с легким алюминием за право называться крылатым металлом. Правда, это было уже давно, лет 35 тому назад.
На страницах газет тогда появились фотографии стальных самолетов. Их конструировал известный авиаконструктор А. И. Путилов. Они демонстрировались на международных выставках и получили там высокую оценку.
Действительно, они были не тяжелее алюминиевых, но значительно долговечнее: ведь изготовлялись они из нержавеющей стали. А бывшие в те времена в распоряжении авиаконструкторов сплавы алюминия очень быстро окислялись.
Но сталь не выдержала соревнования с алюминием. Металлурги нашли способы повысить устойчивость сплавов алюминия против коррозии, и самолеты из этого металла оказались значительно более дешевыми, чем из нержавеющей стали.
Первым промышленным сплавом алюминия был дюралюминий, или, как часто говорят, дюраль. Название это происходит от французского слова «дур» – твердый.
Изобрел дюралюминий французский химик А. Вильм. Он искал добавки, которые могли бы повысить прочность алюминия. Наиболее удачные результаты, с его точки зрения, давали сплавы алюминия с 5 процентами меди, 1 процентом марганца и таким же количеством магния. Полученные из этого сплава образцы в отожженном состоянии обладали пределом прочности до 20 кг на кв. мм.
Но это было еще не все, что мог дать этот сплав. Вильм взял несколько образцов из этого сплава, нагрел их примерно до 600 градусов и опустил в воду. Не закалится ли в результате такой термической обработки этот легкий сплав, как закаляется сталь? Тотчас же, достав из ванны с водой один из прошедших закалку образцов, ученый подверг его испытаниям на разрыв.
Да, оказалось, что предел прочности несколько вырос – образец порвало усилие только в 25 кг на кв. мм. Это уже неплохо – повышение прочности на 25 процентов. Но Вильм хотел большего. Ему нужны были сплавы, способные соперничать по прочности со сталью.
В течение нескольких дней он не возвращался в свою лабораторию. Прошедшие закалку образцы пылились на столе. Вернувшись к своим занятиям, Вильм в первую очередь взял их в руки.
Надо было исследовать их прочность. Для этого они, собственно, и предназначались. Вильм повел испытания. Странно! Первый же образец оказался чуть ли не вдвое прочнее испытанного неделю назад. Он разорвался только при нагрузке около 38 кг на кв. мм. Следующий выдержал 42 кг, третий – 41. Ошибки быть не могло.
Так было открыто интереснейшее явление – старение алюминиевых сплавов после закалки.
Ученые внимательно изучили это явление. Оказалось, что после закалки сплавов алюминия с медью, цинком, магнием и т. д. в течение нескольких дней продолжается их упрочнение. И максимальную прочность в обычных условиях, то есть если старение протекает при комнатной температуре, они приобретают лишь на пятый‑шестой день после закалки.
Что же происходит при этом в кристаллах сплава? Нелегко оказалось выяснить это. При высокой температуре в алюминии растворяется больше меди, чем при низкой. Поэтому, когда мы нагрели сплав, в нем растворилась медь. При быстром охлаждении – закалке – атомы меди не успели выделиться из кристаллической решетки, образовался пересыщенный твердый раствор. И было естественно предположить, что процесс старения состоит в выделении меди из раствора. Но ни металлографический, ни рентгеноструктурный анализ не показывали распада твердого раствора при сгорании.
Процесс оказался сложнее. В процессе старения происходит только подготовка атомов меди к выделению из раствора. Если в свежезакаленном сплаве они находились в случайных местах, то теперь они перестраиваются, занимая четко определенные места в кристаллической решетке. В результате возникают зоны повышенной концентрации меди. Это создает большие напряжения в кристалле и повышает его прочность.
Если провести процесс старения при высокой температуре, то может произойти и выделение меди из твердого раствора. Прочность металла при этом резко снижается.

Надежно, как в доте.
В распоряжении конструкторов имеется в настоящее время множество алюминиевых сплавов. Предел прочности некоторых из них достигает 60–70 кг на кв. мм. Это отличная прочность, но… Но все эти сплавы легко подвергаются коррозии. Ведь в их состав входят различные элементы, создающие крохотные включения, могущие мгновенно стать электродами микроэлементов. Чистому алюминию не хватает прочности сплавов, сплавам – устойчивости чистого алюминия против окисления.
Чтобы соединить положительные свойства сплавов и чистого алюминия, прибегают к плакированию металла. Болванку дюралюминия обертывают листом чистого алюминия и в нагретом виде прокатывают. Металл и сплав свариваются, при этом сплав оказывается как бы в рубашке чистого, коррозионно устойчивого металла.
В тех случаях, когда требуется особенно большая стойкость против коррозии, плакированный металл тщательно обезжиривают и опускают в ванну с крепким раствором серной кислоты. Металл соединяют с анодом. Происходит анодирование металла. На листе возникает защитная пленка окиси алюминия толщиной до десятой доли миллиметра.
В этой пленке при рассматривании в микроскоп можно обнаружить множество мельчайших пор, ведущих в глубь металла. Чтобы они не явились воротами для проникновения к металлу кислорода и воды, их целесообразно заполнить каким‑либо прочным составом. Обычно для этого изделие после анодирования погружают в ванну с раствором соединения калия с хромом.
Вот теперь алюминиевая деталь не боится ни больших нагрузок, ни коррозии.
Мы говорили до сих пор о ковочных алюминиевых сплавах. В первые часы и дни после закалки, когда они обладают большой пластичностью и малой прочностью, их и подвергают механической обработке – прокатке, ковке, обработке резанием. А затем, уже приобретя окончательную форму, они становятся прочными, твердыми.
Кроме ковочных, создана специальная группа и литейных алюминиевых сплавов. Эти сплавы обладают хорошей жидкотекучестью, способностью заполнять все изгибы и пазы формы. Они имеют и небольшую усадку, то есть не образуют внутри отливки раковин и слабин при застывании. Обычно литейные сплавы алюминия содержат в своем составе кремний, медь, магний.
…Откинув назад, словно руки пловец, готовый броситься с вышки в воду, тонкие острые крылья, стоит на взлетной дорожке аэродрома стремительный самолет. Взмах флажка, и уже рокочут его моторы, лопасти пропеллера сливаются в прозрачный, чуть поблескивающий круг. Все быстрее и быстрее бежит он и вдруг отрывается от бетона дорожки. Он в своей родной стихии – в воздухе. Легкий толчок, и скрылись, сложившись, шасси. Еще и еще растут скорость и высота полета.
Крылатый металл – в воздухе. Крылья и фюзеляж – это прокатанный плакированный алюминий. Заклепки (а их сотни тысяч насчитывается в каждом самолете) – тоже алюминиевые, из сплава очень пластичного после закалки и очень прочного после старения. Шасси, блок мотора и множество его деталей отлиты из литейных алюминиевых сплавов.
Металлическая пена
Большой и важной для различных отраслей народного хозяйства группой искусственных полимерных материалов являются пенопласты.
Мне довелось однажды присутствовать на лекции, в ходе которой лектор, кандидат химических наук В. Щеголев, получил в небольшом стеклянном сосуде пенопласт. Он влил на дно этого сосуда совсем немного прозрачной зеленоватой жидкости, всыпал какого‑то белого порошка и тщательно размешал получившуюся смесь стеклянной ложечкой. Затем поставил сосуд на край кафедры и продолжил лекцию.
Вещества в сосуде меж тем не остались в покое. Смесь их начала расти значительно быстрее, чем растет тесто в квашне.
Минут за двадцать белая устойчивая пена заполнила весь сосуд и перелилась тяжелой волной через край. Но лектор не обращал на это внимания.
Вероятно, исчерпав силы своего бунта, вещество перестало расти. Мне все казалось, что еще несколько минут – и пена начнет опадать, пузыри ее будут высыхать, лопаться и снова на дне сосуда останется лишь несколько ложек зеленоватой жидкости. Во всяком случае именно такой вариант предсказывал мой житейский опыт: ведь именно так вела себя мыльная пена, когда я намыливал щеку и меня в это время срочно приглашали к телефону; это же происходило и с несъеденной вовремя порцией мусса. Но не тут‑то было!
Щеголев кончил лекцию, взял в руки сосуд и вытряхнул из него пену. Нет, она не разлилась по столу, она сохранила форму сосуда. Всего за двадцать минут она застыла, затвердела. И вела она себя не как мыльная пена, а скорее как тесто. Ведь обыкновенная булочка, которую вы съедаете за завтраком, – это и есть застывшая пена теста, она вся пронизана крохотными пузырьками газа.
Пенопласты обладают удивительными свойствами. Прежде всего это чрезвычайно легкий материал. Целую глыбу его может легко поднять один человек. Это делает пенопласты чрезвычайно полезными во всех транспортных устройствах, где вреден излишний вес.
Пенопласты обладают отличными теплоизоляционными свойствами. Ведь воздух является отличным теплоизолятором – недаром именно слоем воздуха отгораживаемся мы от зимних холодов, вставляя в окна двойные рамы. Звук «вязнет» в пенопласте, обессиленный бесчисленными перегородками между воздушными пузырями. Все эти свойства делают пенопласт лучшим строительным изоляционным материалом.
Но пенопласты обладают и большим недостатком: их прочность невысока. Вот если бы удалось получить каким‑либо способом пенометалл, он нашел бы еще более широкое распространение: ведь прочность его была бы куда выше, чем у пенопластов.
Писатель‑фантаст Ю. С. Моралевич написал даже научно‑фантастический рассказ о нефтеналивном судне, построенном из пенометалла, которое обладало удивительными свойствами: в частности, оно было непотопляемым – ведь материал, из которого судно было изготовлено, плавал на воде, как пробка.
Опытов в этом направлении ведется много. В печати недавно, в частности, появилось сообщение о разработанной технологии получения пеноалюминия.
Изготовляется пеноалюминий следующим образом. В расплавленном алюминии растворяют гидриды циркония, бария, лития. Расплав выдерживают несколько минут при температуре около 657 градусов. Молекулы гидридов распадаются, выделяя водород. Он и заполняет бесчисленные образующиеся в толще металла поры диаметром до нескольких миллиметров. Металл начинает стремительно «расти». Так как водород очень летуч и пузыри его быстро поднимаются к поверхности металла и там лопаются, алюминий надо моментально охладить. Это осуществляют струей холодной воды.
Пеноалюминий обладает очень низким удельным весом – в зависимости от дозировки и точности технологии вес куб. см этого материала колеблется от 0,19 до 0,64 г. Следовательно, пеноалюминий плавает на воде, как пробка или как бальзовое дерево, из которого был построен знаменитый плот «Кон‑Тики».
Трудно сказать, окажется ли первенец в семействе пенометаллов – пеноалюминий, технология производства которого разработана американскими учеными, тем удивительным материалом, о котором вместе с писателями‑фантастами мечтают и инженеры. Но нет сомнения, что появятся и пенотитан, и пеносталь, и пенобериллий, и разнообразнейших свойств пеносплавы.
Пенометаллам принадлежит большое будущее. Но так много еще неизвестного в этой области металлургии! И в первую очередь неизвестны пути получения таких металлов.
Соперник и союзник
«За последние годы все большее значение приобретает алюминий, как металл разностороннего применения в промышленности и в строительстве, – сказал в своем докладе „О контрольных цифрах развития народного хозяйства СССР на 1959–1965 годы“ на внеочередном XXI съезде КПСС Никита Сергеевич Хрущев. – Поэтому производство алюминия за семилетие предполагается увеличить в 2,8–3 раза. Для такого роста у нас имеется достаточная энергетическая и сырьевая база».
И все же у алюминия, как крылатого металла авиации, как металла астронавтики, есть очень серьезный соперник. Это один из целого ряда металлов, впервые полученных английским химиком Г. Дэви. Свежий разрез его имеет серебристо‑белый цвет. Он плавится при 651 градусе, кипит при 1120 градусах. Однако нагретый на воздухе до температуры всего около 550 градусов, он вспыхивает и стремительно сгорает нестерпимо ярким пламенем. Это магний.

Перевес – здесь не преимущество.
Можно много рассказывать о его свойствах. О том, что на воздухе его яркий блеск быстро погасает: он покрывается тонкой пленкой тусклой окиси. О том, что он почти не реагирует с холодной водой, но из горячей вытесняет водород. О том, что в атмосфере влажного хлора он загорается уже при комнатной температуре и хорошо растворяется в разбавленных кислотах. И все это будет правильно, но все это еще не важнейшее свойство магния. Важнейшее – его малый удельный вес.
Он равен 1,738 г на куб. см. Вспомним, что удельный вес крылатого металла сегодняшнего дня – алюминия, о котором мы только что говорили, равен 2,7 г на куб. см. Значит, имея сплавы магния, равные по прочности сплавам алюминия, можно изготовить самолет, на треть более легкий, чем из алюминия.
Да, магний – тоже крылатый металл и сегодняшнего и завтрашнего дня!
Магний – один из распространенных в природе металлов. Земная кора на 2,3 процента состоит из магния. Он входит в состав около 200 минералов из примерно 1500 известных и исследованных. В морской воде содержится 0,14 процента магния. Он является неизбежной составной частью растительных и животных организмов. В некоторых видах морских водорослей он составляет до 3 процентов по весу, в известковых губках – до 4 процентов. Магний входит в состав хлорофилла и таким образом участвует в великой реакции образования органических веществ. Ученые подсчитали, что только в хлорофилле земных растений содержится около 100 млрд. тонн магния. Недостаток магния в почве вызывает тяжелые заболевания растений, в пище – болезни животных.
Магний поистине вездесущ, запасы его неисчерпаемы, но в течение длительного времени он не находил себе широкого применения. Только в 20‑х годах, всего лет 35 назад, впервые использовали его в сплавах.
В 1937 году производство магния достигло 20 тысяч тонн, в 1940 – перевалило через 35 тысяч тонн, а в 1943 – превысило 250 тысяч тонн. Причем в этих цифрах не учитывается производство магния в Советском Союзе.
Большая часть металлического магния идет на производство сплавов, ибо в чистом виде магний как конструкционный металл применяться не может: он слишком мягкий и непрочный.
Есть такое понятие – удельная прочность. Это отношение предела прочности на разрыв к удельному весу материала. Мы уже проводили сравнение по удельной прочности, когда сравнивали сплавы алюминия и сталь. Сплавы магния по удельной прочности приближаются к дюралюминию.
Применение магниевых сплавов понижает вес деталей на 20–30 процентов по сравнению с алюминиевыми и на 50–75 процентов по сравнению с чугуном и сталью.
Наибольшее применение имеют магниевые сплавы, содержащие до 11 процентов алюминия, 4 процентов цинка и 2,5 процента марганца. Алюминий и цинк в этом содружестве металлов увеличивают прочность сплава, а марганец резко повышает его антикоррозийную способность. В некоторые сплавы магния вводят литий, бериллий, кальций, кадмий, церий, титан и т. д. Одни из этих добавок увеличивают жаростойкость сплавов, другие повышают пластичность, понижают окисляемость и т. д. Вредным считается присутствие железа, кремния, меди и никеля. Присутствие этих элементов снижает механические свойства сплавов, уменьшает сопротивляемость коррозии.
Как и сплавы алюминия, магниевые сплавы делятся на две большие группы – используемые для литья и применяемые после обработки давлением.
Наиболее часто встречаются литые магниевые изделия.
Работа со сплавами магния очень своеобразна. Так, например, расплавленные сплавы этого металла при соприкосновении с воздухом загораются, поэтому и плавку и литье приходится вести под слоем шлака. Однако мнение, распространенное довольно широко, что изделия из магниевых сплавов вообще огнеопасны и могут загораться от случайных причин, не соответствует действительности.
Да, распыленный в воздухе порошок магниевого сплава взрывоопасен. Поэтому, ведя шлифовку или полировку магниевых изделий, надо следить, чтобы хорошо работали пылеотсасывающие устройства. Да, опасна в пожарном отношении и стружка магниевого сплава. Но изделие из сплава магния можно поджечь, только расплавив его. Да и это нелегко сделать: большая теплопроводность сплава обеспечит быстрое охлаждение нагреваемого места.
Магниевые сплавы – это новые возможности еще уменьшить вес и увеличить грузоподъемность самолета, железнодорожного вагона, автомобиля, поэтому применение их все растет.
Во многих странах ведутся интенсивные поиски лучших по качеству сплавов магния. И все‑таки работы в этой области еще только начаты. Еще не открыт тот лучший состав сплава, который станет классическим. Еще неизвестны ни легирующие примеси, которые войдут в его состав, ни процентное соотношение этих примесей, ибо еще не построены многие двойные и тройные диаграммы состояния сплавов магния с другими элементами.
…А он будет, обязательно будет найден – сверхпрочный магниевый сплав, против которого будет почти бессильна коррозия и который будет абсолютно негорючим! Он просто ждет еще своего открывателя.
Но магний находит себе применение и в чистом виде. Его используют для изготовления осветительных и сигнальных ракет, зажигательных снарядов и авиабомб. Та же самая яркая вспышка магния, которую применяли фотографы до изобретения блиц‑ламп при фотографировании в темных помещениях или ночью, может зажигать истребляющие пожары, губить труд и жизни людей. В металлургии черных металлов магний служит в качестве легирующей добавки. С помощью магния получают и трудновосстановимые титан и ванадий, очищают от серы никель и некоторые сплавы.
Как же получают этот металл?
Снова электролиз
Советский Союз обладает огромнейшими залежами магниевых руд. Магнезит есть у нас на Среднем Урале и в Оренбургской области, доломит– в Донбассе, Московской и Ленинградской областях и т. д., кар‑налит – в Соликамске (Урал), бишофит – в озерах Крыма, в Кара‑Богаз‑Голе и озере Эльтон. И это далеко не полный список, ибо даже простая морская вода может служить неисчерпаемым сырьем для производства магния.
Как и алюминий, металлический магний рождается в электролитической ванне. Однако, прежде чем попасть в электролитическую ванну, руды магния, помимо обычного обогащения, проходят ту или иную обработку, изменяющую их состав.
Бишофит, добываемый из соленых озер выпариванием воды, подвергают двухстадийному процессу обезвоживания. Первая стадия осуществляется прокаливанием во вращающихся цилиндрических печах (мы уже не раз встречались с печами такого типа в различных металлургических процессах). Однако при этом удается избавиться лишь от части входящей в состав молекулы бишофита воды. Если поднять температуру процесса, то начнет появляться окисел магния, что нежелательно. Поэтому окончательное обезвоживание проводят в другой вращающейся печи, обогреваемой снаружи и заполненной газообразным хлором.
Полученный полупродукт неизбежно содержит в себе некоторый процент окиси магния. Чтобы избавиться от нее, полупродукт плавят в шахтных электрических печах. Процесс ведется таким образом, чтобы нежелательная примесь ушла в шлак. Отстоявшийся чистый хлорид магния выпускают в ковш с плотно закрывающейся крышкой и направляют на электролиз.
Руды, имеющие другой химический состав, перерабатываются иными способами. Все они являются достаточно сложными. И во всех случаях в итоге получают безводное соединение хлора с магнием.
Электролиз магния, пожалуй, еще сложнее, чем электролиз алюминия. Магний легче расплава хлорида магния, из которого он был получен, поэтому он всплывает на поверхность. Одновременно с выделением магния на другом электроде ванны происходит выделение хлора. Значит, ванна должна быть постоянно закрыта. Все это вызывает дополнительные трудности.
Но вот вакуум‑ковш приблизился к электролизной ванне и наполнился легким серебристым металлом. Его разлили в изложницы и получили слитки. Нет, это еще не чистый металл. Его надо подвергнуть дополнительной очистке – рафинированию.
Обычно применяются два способа такого рафинирования: первый состоит в переплавке магния с флюсами; второй, позволяющий получить магний весьма высокой чистоты, заключается в возгонке магния в вакууме.
Для рафинирования возгонкой используются специальные вакуум‑аппараты – стальные цилиндрические реторты с герметически закрывающимися крышками. На дно этих реторт закладывают очищаемый магний и откачивают воздух. Затем нижнюю часть аппарата нагревают, в то время как верхняя охлаждается наружным воздухом.
В аппарате под влиянием нагрева происходит возгонка магния. Он становится газообразным, минуя жидкое состояние: ведь температура, при которой идет процесс, равна 580–600 градусам. Пары магния поднимаются в верхнюю часть аппарата и там осаждаются на его стенках. Конечно, и часть примесей проделывает этот же путь, но те из них, которые возгоняются легче магния, осаждаются в самой верхней части аппарата, а те, что возгоняются трудно, осаждаются в нижней части конденсатора. Большая часть металла – до 80 процентов – имеет чистоту не менее «четырех девяток», то есть содержит не меньше 99,99 процента магния. Эта чистота может быть еще повышена повторной возгонкой.
Так рождается этот металл – соперник и друг алюминия. Соперник– потому, что по ряду качеств превосходит он сегодняшний главный крылатый металл. Друг – потому, что содружество этих металлов позволяет получить наиболее ценные технические сплавы. Ведь в состав дюралюминия входит магний, а в состав лучших сплавов магния – алюминий.
Но и у магния и алюминия есть еще более опасный соперник на право называться крылатым металлом будущего и особенно – металлом межпланетных рейсов.
Дата добавления: 2016-01-29; просмотров: 1354;
