Союз углерода и кремния
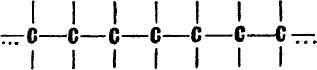
Два элемента в природе могут претендовать на особое положение. Во‑первых, углерод. Он основа всего живого. И в первую очередь потому, что углеродные атомы способны прочно соединяться друг с другом, образуя цепеобразные соединения:
Во‑вторых, кремний. Он основа всей неорганической природы. Но атомы кремния не могут образовать столь длинных цепочек, как атомы углерода, а потому соединений кремния, встречающихся в природе меньше, чем соединений углерода, хотя и значительно больше, чем соединений любых других химических элементов.
Ученые решили «исправить» этот недостаток кремния. В самом деле, ведь кремний так же четырехвалентен, как и углерод. Правда, связь между атомами углерода значительно прочнее, чем между атомами кремния. Но зато кремний не такой активный элемент.
И если бы удалось получить с его участием соединения, подобные органическим, какими удивительными свойствами они могли бы обладать!
Сначала ученым не повезло. Правда, было доказано, что кремний может образовывать соединения, в которых его атомы чередуются с атомами кислорода:
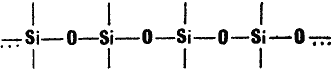
Однако они оказались малоустойчивыми.
Успех пришел, когда атомы кремния решили совместить с атомами углерода. Такие соединения, получившие название кремнийорганических, или силиконов, действительно обладают рядом уникальных свойств. На их основе были созданы различные смолы, позволяющие получать пластические массы, устойчивые в течение длительного времени к действию высоких температур.
Каучуки, изготовленные на основе кремнийорганических полимеров, обладают ценнейшими качествами, например теплостойкостью. Некоторые сорта силиконовой резины устойчивы до температуры в 350 градусов. Представьте себе автомобильную покрышку, сделанную из такой резины.
Силиконовые каучуки совершенно не набухают в органических растворителях. Из них стали изготовлять различные трубопроводы для перекачки горючего.
Некоторые силиконовые жидкости и смолы почти не меняют вязкость в широком интервале температур. Это открыло им дорогу для применения в качестве смазочных материалов. Вследствие малой летучести и высокой температуры кипения силиконовые жидкости нашли широкое применение в насосах для получения высокого вакуума.
Кремнийорганические соединения обладают водоотталкивающими свойствами, и это ценное качество было учтено. Их стали использовать при изготовлении водоотталкивающей ткани. Но дело не только в тканях. Известна пословица «вода камень точит». На строительстве важных сооружений опробовали защиту строительных материалов различными кремнийорганическими жидкостями. Опыты прошли успешно.
На основе силиконов в последнее время были созданы прочные температуростойкие эмали. Пластинки меди или железа, покрытые такими эмалями, в течение нескольких часов выдерживают нагревание до 800 градусов.
И это лишь начало своеобразного союза углерода и кремния. Но такой «двойственный» союз уже не удовлетворяет химиков. Они поставили задачу ввести в молекулы кремнийорганических соединений и другие элементы, такие, как, например, алюминий, титан, бор. Ученые успешно разрешили проблему. Так родился совершенно новый класс веществ – полиорганометаллосилоксаны. В цепочках таких полимеров могут быть разные звенья: кремний – кислород – алюминий, кремний – кислород – титан, кремний – кислород – бор и другие. Подобные вещества плавятся при температурах 500–600 градусов и в этом смысле составляют конкуренцию многим металлам и сплавам.
В литературе как‑то промелькнуло сообщение, что японским ученым будто бы удалось создать полимерный материал, выдерживающий нагрев до 2000 градусов. Возможно, это ошибка, но ошибка, которая не так уж далека от истины. Ибо термин «жаростойкие полимеры» уже скоро должен войти в длинный перечень новых материалов современной техники.
Удивительные сита
Устроены эти сита довольно оригинально. Они представляют собой гигантские органические молекулы, обладающие рядом интересных свойств.
Во‑первых, как и многие пластмассы, они нерастворимы в воде и органических растворителях. А во‑вторых, в них входят так называемые ионогенные группы, то есть группы, которые в растворителе (в частности в воде) могут давать те или иные ионы. Таким образом, эти соединения относятся к классу электролитов.
Ион водорода в них может замещаться каким‑нибудь металлом. Так происходит обмен ионов.
Эти своеобразные соединения получили название ионообменников. Те из них, что способны взаимодействовать с катионами (положительно заряженными ионами), называют катионитами, а те, которые взаимодействуют с отрицательно заряженными ионами, именуют анионитами. Первые органические ионообменники были синтезированы в середине 30‑х годов нашего столетия. И сразу же завоевали самое широкое признание. Да это и не удивительно. Ведь с помощью ионообменников можно превращать жесткую воду в мягкую, соленую – в пресную.

Представьте себе две колонки – одна из них наполнена катионитом, другая – анионитом. Допустим, мы задались целью очистить воду, содержащую обычную поваренную соль. Мы пропускаем воду сначала через катионит. В нем все ионы натрия «обменяются» на ионы водорода, и в нашей воде вместо хлористого натрия будет уже присутствовать соляная кислота. Затем мы пропускаем воду через анионит. Если он находится в гидроксильной форме (то есть анионами, способными к обмену, у него являются ионы гидроксила), все ионы хлора будут заменены в растворе ионами гидроксила. Ну, а ионы гидроксила со свободными ионами водорода немедленно образуют молекулы воды. Таким образом, вода, содержавшая первоначально хлористый натрий, пройдя через ионообменные колонки, стала совершенно обессоленной. По своим качествам она может поспорить с лучшей дистиллированной водой.
Но не только опреснение воды принесло ионитам широкую известность. Оказалось, что ионы по‑разному, с различной силой, удерживаются ионитами. Ионы лития удерживаются сильнее, чем ионы водорода, ионы калия – сильнее, чем натрия, ионы рубидия – сильнее, чем калия, и так далее. С помощью ионитов стало возможным очень легко проводить разделение различных металлов. Большую роль играют иониты сейчас и в различных отраслях промышленности. Например, на фотографических фабриках долгое время не было подходящего способа улавливания драгоценного серебра. Именно ионитовые фильтры решили эту важную задачу.
Ну, а сможет ли человек когда‑нибудь использовать иониты для извлечения ценных металлов из морской воды? На этот вопрос нужно ответить утвердительно. И хотя морская вода содержит огромное количество различных солей, по‑видимому, получение благородных металлов из нее дело недалекого будущего.
Сейчас трудность в том, что при пропускании морской воды через катионит, соли, которые в ней есть, фактически не дают возможности осесть небольшим примесям ценных металлов на катионите. Однако в последнее время синтезированы так называемые электронообменные смолы. Они не только обменивают свои ионы на ионы металла из раствора, но еще и способны восстанавливать этот металл, отдавая ему электроны. Недавние опыты с такими смолами показали, что если через них пропускать раствор, содержащий серебро, то вскоре на смоле осаждаются не ионы серебра, а металлическое серебро, причем смола в течение длительного периода сохраняет свои свойства. Таким образом, если через электронообменник пропускать смесь солей, ионы, которые наиболее легко восстанавливаются, могут превратиться в атомы чистого металла.
Химические клешни
Как утверждает старый анекдот, ловить львов в пустыне проще простого. Поскольку пустыня состоит из песка и львов, надо взять сито и просеять пустыню. Песок пройдет сквозь отверстия, а львы останутся на решетке.
А что делать, если есть ценный химический элемент в смеси с огромным количеством тех, что не представляют для вас какой‑либо ценности? Или необходимо очистить какое‑либо вещество от вредной примеси, содержащейся в весьма малых количествах.
Такое случается нередко. Примесь гафния в цирконии, который используется в конструкциях ядерных реакторов, не должна превышать нескольких десятитысячных процента, а в обычном цирконии его около двух десятых процента.

Эти элементы очень похожи по химическим свойствам, и обычные методы здесь, как говорится, не срабатывают. Даже удивительное химическое сито. А между тем требуется цирконий исключительно высокой степени чистоты…
Веками химики следовали немудреному рецепту: «Подобное растворяется в подобном». Неорганические вещества хорошо растворяются в неорганических растворителях, органические – в органических. Многие соли минеральных кислот хорошо растворяются в воде, безводной плавиковой кислоте, в жидкой цианистоводородной (синильной) кислоте. Очень многие органические вещества довольно хорошо растворимы в органических растворителях – бензоле, ацетоне, хлороформе, сернистом углероде и т. д. и т. п.
А как будет вести себя вещество, которое является чем‑то промежуточным между соединениями органическими и неорганическими? Вообще‑то химикам были знакомы до некоторой степени такие соединения. Так, хлорофилл (красящее вещество зеленого листа) органическое соединение, содержащее атомы магния. Он хорошо растворим во многих органических растворителях. Существует огромное количество неизвестных природе, искусственно синтезированных металлоорганических соединений. Многие из них способны растворяться в органических растворителях, причем эта способность зависит от природы металла.
На этом и решили сыграть химики.
В ходе работы ядерных реакторов время от времени возникает необходимость заменять отработанные урановые блоки, хотя количество примесей (осколков деления урана) в них обычно не превышает тысячной доли процента. Сначала блоки растворяют в азотной кислоте. Весь уран (и другие металлы, образовавшиеся в результате ядерных превращений) переходит в азотнокислые соли. При этом одни примеси, как ксенон, йод, автоматически удаляются в виде газов или паров, Другие, например олово, остаются в осадке.
Но получившийся раствор, кроме урана, содержит примеси многих металлов, в частности плутоний, нептуний, редкоземельные элементы, технеций и некоторые другие. Вот здесь и приходят на помощь органические вещества. Раствор урана и примесей в азотной кислоте смешивают с раствором органического вещества – трибутилфосфата. При этом практически весь уран переходит в органическую фазу, а примеси остаются в азотнокислом растворе.
Такой процесс получил название экстракции. После двукратной экстракции уран почти освобождается от примесей и может быть снова использован для изготовления урановых блоков. А оставшиеся примеси идут на дальнейшее разделение. Из них извлекут наиболее важные части: плутоний, некоторые радиоактивные изотопы.
Подобным же образом можно разделить цирконий и гафний.
Экстракционные процессы получили сейчас широкое распространение в технике. С их помощью проводят не только очистку неорганических соединений, но и многих органических веществ – витаминов, жиров, алкалоидов.
Дата добавления: 2016-01-26; просмотров: 1736;
